Возможности совмещённой позитронно-эмиссионной и компьютерной томографии в сравнительной оценке эффекта различных вариантов таргетной терапии у больных немелкоклеточным раком лёгкого с наличием мутации в гене EGFR
- Авторы: Струтынский В.А.1,2, Синицын В.Е.1, Платонова О.Е.2
-
Учреждения:
- Московский государственный университет имени М.В. Ломоносова
- АО «Медицина»
- Выпуск: Том 5, № 3 (2024)
- Страницы: 394-406
- Раздел: Оригинальные исследования
- URL: https://bakhtiniada.ru/DD/article/view/310026
- DOI: https://doi.org/10.17816/DD624504
- ID: 310026
Цитировать
Полный текст
Аннотация
Обоснование. В отечественной медицинской литературе отсутствуют публикации, посвящённые изучению возможностей метода позитронной эмиссионной томографии, совмещённой с компьютерной томографией, в сравнительной оценке эффекта различных вариантов таргетной терапии с использованием ингибиторов тирозинкиназы у пациентов с немелкоклеточным раком лёгкого и мутацией в гене EGFR.
Цель — изучить возможности совмещённой позитронно-эмиссионной и компьютерной томографии с использованием критериев RECIST 1.1 и изменений метаболических показателей SUVmax и SUVmean в сравнительной оценке ответа опухоли на таргетную монотерапию и комбинированное лечение ингибиторами тирозинкиназы у пациентов с немелкоклеточным раком лёгкого и мутацией в гене EGFR.
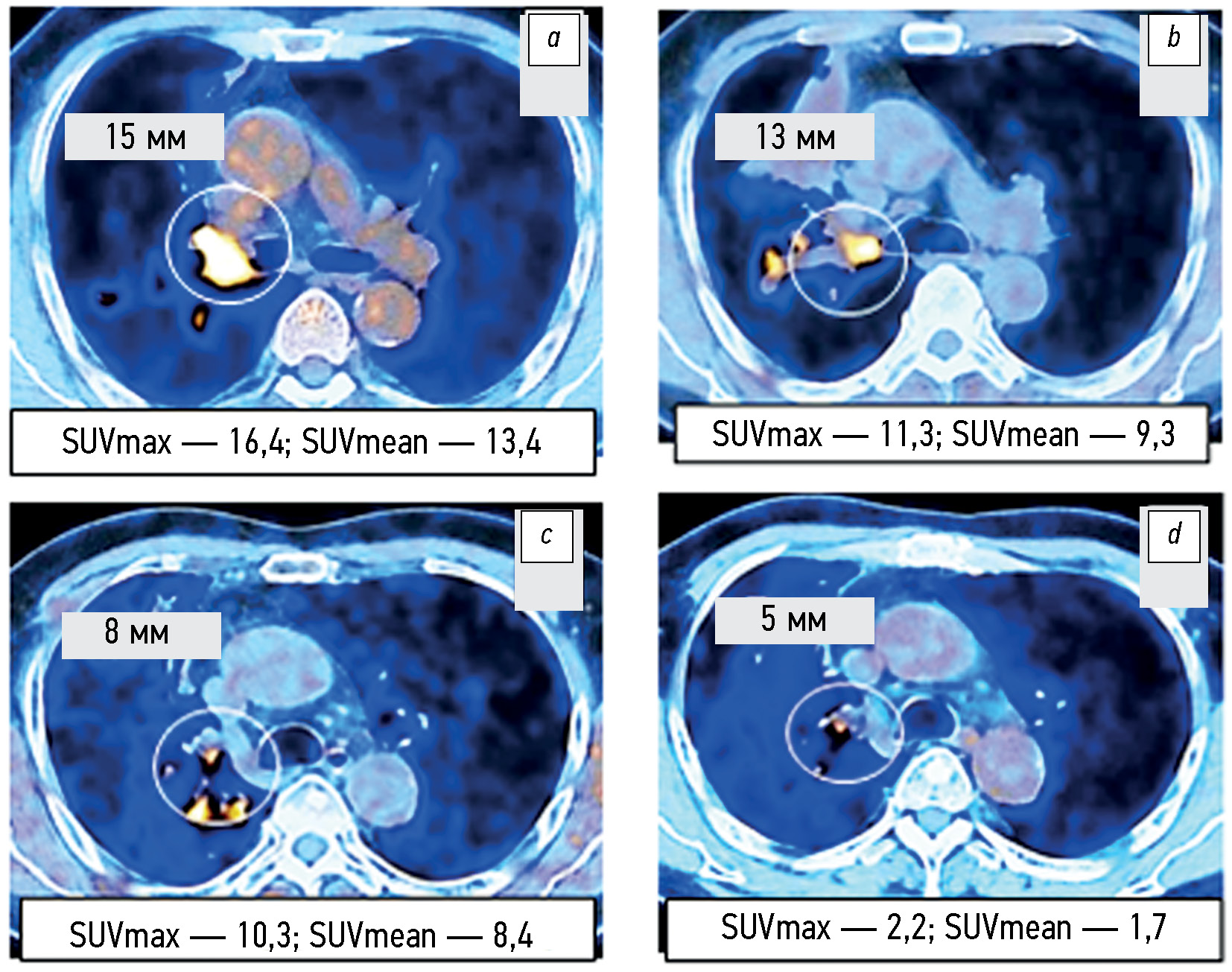
Материалы и методы. Проанализированы протоколы исследований совмещённой позитронно-эмиссионной и компьютерной томографии с 18F-фтордезоксиглюкозой (18F-ФДГ) 105 пациентов с немелкоклеточным раком лёгкого, в том числе 75 — с активирующей мутацией в гене EGFR, выполненных в период с 2019 г. по 2022 г. Лучевая нагрузка подбиралась индивидуально и составляла от 45 до 90 мЗв. Объёмная активность радиофармпрепарата 18F-ФДГ — 260–500 МБк. Оценивали изменение суммы наибольших диаметров целевых очагов и метаболических показателей SUVmax и SUVmean до лечения и через 1,5–2,0 месяца от начала терапии. У 17 пациентов с немелкоклеточным раком лёгкого длительность наблюдения за изменениями позитронной эмиссионной томографии, совмещённой с компьютерной томографией, составила не менее 12 месяцев.
Результаты. По данным совмещённой позитронно-эмиссионной и компьютерной томографии и изменениям метаболических показателей SUVmax и SUVmean у пациентов с немелкоклеточным раком лёгкого и мутацией в гене EGFR 2-й и 3-й групп, получавших комбинированную терапию ингибиторами тирозинкиназы в сочетании с бевацизумабом или химиотерапией, прогрессирование заболевания выявлялось достоверно реже (p=0,043 и p=0,029), чем у пациентов 1-й группы и группы контроля (4,2% против 20,0–21,8%). Имелась также недостоверная тенденция (p=0,092) к более высокой частоте выявления частичного ответа на лечение (58,3% против 40,0%). Аналогичные изменения суммы наибольших диаметров целевых очагов на раннем этапе лечения оказались статистически незначимыми (p=0,187). Показано, что при длительном наблюдении за частью пациентов с немелкоклеточным раком лёгкого не менее чем в 50% случаев изменения суммы наибольших диаметров повторяют соответствующие изменения SUVmax и SUVmean, выявленные при 1-м контрольном исследовании.
Заключение. По данным позитронной эмиссионной томографии, совмещённой с компьютерной томографией, и изменениям метаболических показателей SUVmax и SUVmean показано, что ранний ответ опухоли на комбинированное лечение ингибиторами тирозинкиназы в сочетании с бевацизумабом или химиотерапией по сравнению с ответом на таргетную монотерапию ингибиторами тирозинкиназы или химиотерапевтическое лечение больных контрольной группы характеризуется достоверно более низкой частотой метаболического прогрессирования заболевания, хотя аналогичная тенденция суммы наибольших диаметров целевых очагов по критериям RECIST 1.1 была статистически незначимой. Изменение метаболических показателей SUVmax и SUVmean на раннем этапе лечения не менее чем в 50% случаев опережает аналогичные изменения суммы наибольших диаметров целевых очагов, что может быть использовано для своевременного выделения группы больных с высоким риском дальнейшего прогрессирования, определяемым по критериям RECIST 1.1.
Полный текст
Открыть статью на сайте журналаОб авторах
Владислав Андреевич Струтынский
Московский государственный университет имени М.В. Ломоносова; АО «Медицина»
Автор, ответственный за переписку.
Email: Rammen2@yandex.ru
SPIN-код: 6810-5644
Россия, Москва; Москва
Валентин Евгеньевич Синицын
Московский государственный университет имени М.В. Ломоносова
Email: Vsini@mail.ru
ORCID iD: 0000-0002-5649-2193
SPIN-код: 8449-6590
д-р мед. наук, профессор
Россия, МоскваОксана Евгеньевна Платонова
АО «Медицина»
Email: Platonova@medicina.ru
ORCID iD: 0000-0003-0093-7285
канд. мед. наук
Россия, МоскваСписок литературы
- Злокачественные новообразования в России в 2019 году (заболеваемость и смертность) / под ред. А.Д. Каприна, В.В. Старинского, А.О. Шахзадовой. Москва : Московский государственный научно–исследовательский медицинский институт им. П.А. Герцена, 2020.
- Сакаева Д.Д., Реутова Е.В. Таргетная терапия метастатического немелкоклеточного рака лёгкого. В: Рак лёгкого / под ред. К.К. Лактионова, В.В. Бредера. Москва : «Гранат», 2020. С. 75–88.
- Тюляндин С.А. Таргетная терапия: Двадцать лет успехов и поражений // Практическая онкология. 2019. Т. 20, № 4. С. 274–288. doi: 10.31917/2004274
- Deng W., Wang K., Jiang Y., et al. Erlotinib plus bevacizumab versus erlotinib alone in patients with EGFR-positive advanced non-small-cell lung cancer: a systematic review and meta-analysis of randomised controlled trials // BMJ Open. 2022. Vol. 12, N 8. P. e062036. doi: 10.1136/bmjopen-2022-062036
- Landre T., Des Guetz G., Chouahnia R., et al. First-line angiogenesis inhibitor plus erlotinib versus erlotinib alone for advanced non-small-cell lung cancer harboring an EGFR mutation // Cancer Res Clin Oncol. 2020. Vol. 146, N 12. P. 3333–3339. doi: 10.1007/s00432-020-03311-w
- Maemondo M., Fukuhara T., Saito H., et al. NEJ026: Final overall survival analysis of bevacizumab plus erlotinib treatment for NSCLC patients harboring activating EGFR-mutations // Journal of Clinical Oncology. 2020. Vol. 38, N 15. P. 9506–9506. doi: 10.1200/JCO.2020.38.15_suppl.9506
- Rocco D., Della Gravara L., Palazzolo G., et al. The role of antiangiogenic monoclonal antibodies combined to EGFR-TKIs in the treatment of advanced non-small cell lung cancer with activating EGFR mutations: acquired resistance mechanisms and strategies to overcome them // Cancer Drug Resist. 2022. Vol. 5, N 4. P. 1016–1024. doi: 10.20517/cdr.2022.77
- Saito H., Fukuhara T., Furuya N., et al. Erlotinib plus bevacizumab versus erlotinib alone in patients with EGFR-positive advanced non-squamous non-small-cell lung cancer (NEJ026): interim analysis of an open-label, randomised, multicentre, phase 3 trial // Lancet Oncol. 2019. Vol. 20, N 5. P. 625–635. doi: 10.1016/S1470-2045(19)30035-X
- Stinchcombe T.E., Jänne P.A., Wang X., et al. Effect of Erlotinib Plus Bevacizumab vs Erlotinib Alone on Progression-Free Survival in Patients With Advanced EGFR-Mutant Non-Small Cell Lung Cancer: A Phase 2 Randomized Clinical Trial // JAMA Oncol. 2019. Vol. 5, N 10. P. 1448–1455. doi: 10.1001/jamaoncol.2019.1847
- Мещерякова Н.А. Позитронно-эмиссионная томография в сочетании с компьютерной томографией в диагностике и оценке эффективности лечения немелкоклеточного рака лёгкого : автореф. дисс. канд. мед. наук. Москва, 2018.
- Мещерякова Н.А., Долгушин М.Б., Борисова Т.Н., Давыдов М.М., Лактионов К.К. Эффективность 18F-ФДГ и 18F-FLT ПЭТ/КТ для оценки химиолучевой терапии у пациента с немелкоклеточным раком лёгкого (клиническое наблюдение) // Медицинская визуализация. 2017. № 1. С. 53–56. doi: 10.24835/1607-0763-2017-1-53-56
- Wahl R., Jacene Н., Kasamon Y., Lodge M. From RECIST to PERCIST: Evolving Considerations for PET Response Criteria in Solid Tumors // J Nucl Med. 2009. Vol. 50, N 5. P. 4–11. doi: 10.2967/jnumed.111.093443
- Гележе П.Б., Морозов С.П., Шавладзе Н. Сравнение точности оценки коррекции поглощения и размера опухоли при последовательной ПЭТ/КТ с 18F-ФДГ и ПЭТ/МРТ молочных желез // Вестник РНЦРР. 2019. Т. 19, № 4. С. 48–62. EDN: LWGHUU
- Ding Q., Chen X., Yang L., et al. PET/CT evaluation of response to chemotherapy in non-small cell lung cancer: PET response criteria in solid tumors (PERCIST) versus response evaluation criteria in solid tumors (RECIST) // J Thorac Dis. 2014. Vol. 6, N 6. P. 677–683. doi: 10.3978/j.issn.2072-1439.2014.05.10
- Pierson C., Grinchak T., Sokolovic C., et al. Response criteria in solid tumors (PERCIST/RECIST) and SUVmax in early-stage non-small cell lung cancer patients treated with stereotactic body radiotherapy // Radiat Oncol. 2018. Vol. 13, N 1. P. 34. doi: 10.1186/s13014-018-0980-7
- Beer L., Hochmair M., Haug A.R., et al. Comparison of RECIST and PERCIST for the Evaluation of Response to PD-1/PD-L1 Blockade Therapy in Patients With Non-Small Cell Lung Cancer // Clin Nucl Med. 2019. Vol. 44, N 7. P. 535–543. doi: 10.1097/RLU.0000000000002603
- Kaira K., Higuchi T., Naruse I., et al. Metabolic activity by 18 F–FDG-PET/ CT is predictive of early response after nivolumab in previously treated NSCLC // Eur J Nucl Med Mol Imaging. 2018. Vol. 45, N 1. P. 56–66. doi: 10.1007/s00259-017-3806-1
- Ходжибекова М.М. Значение комбинированной ПЭТ/КТ в диагностике и мониторинге лечения больных лимфомами : автореф. дисс. ... канд. мед. наук. Москва, 2019.
- Koopman D., Jager P.L., Slump C.H., et al. SUV variability in EARL-accredited conventional and digital PET // EJNMMI Res. 2019. Vol. 9, N 1. P. 106. doi: 10.1186/s13550-019-0569-7
- Xie X., Chen H., Yang H., Lin H. Predictive value of positron emission tomography for the prognosis of molecularly targeted therapy in solid tumors // Z Onco Targets Ther. 2018. Vol. 7, N 11. P. 8885–8899. doi: 10.2147/OTT.S178076
- Kamiyoshihara M., Igai H., Ohsawa F., Numajiri K., et al. Gefitinib Monotherapy Afforded Long-Term Survival of an Octogenarian Patient with a Postoperative Recurrence of a Pulmonary Adenocarcinoma — A Case Report // Gan To Kagaku Ryoho. 2023. Vol. 50, N 2. P. 187–189.
- Stinchcombe T.E. Foreword: Gefitinib in Non-Small-Cell Lung Cancer: The IDEAL 1 Trial // J Clin Oncol. 2023. Vol. 41, N 6. P. 1159–1160. doi: 10.1200/JCO.22.02660
- Zhong W.Z., Wang Q., Mao W.M., et al. Gefitinib versus vinorelbine plus cisplatin as adjuvant treatment for stage II-IIIA (N1-N2) EGFR-mutant NSCLC (ADJUVANT/CTONG1104): a randomised, open-label, phase 3 study // Lancet Oncol. 2018. Vol. 19, N 1. P. 139–148. doi: 10.1016/S1470-2045(17)30729-5
- Liu M., Luo N., Fang Z., Liu Q., et al. The efficacy and toxicity of maintenance therapy with bevacizumab plus pemetrexed versus bevacizumab/pemetrexed alone for stage IIIB/IV nonsquamous non-small cell lung cancer: A meta-analysis of randomized controlled trials // Clin Pharm Ther. 2022. Vol. 47, N 2. P. 157–167. doi: 10.1111/jcpt.13534
- Chen Z., Shen S. Intercalated combination of chemotherapy and erlotinib for stage IIIA non-small-cell lung cancer: a multicenter, open-label, single-arm, phase II study // Cancer Manag Res. 2019. Vol. 11. P. 6543–6552. doi: 10.2147/CMAR.S189287
Дополнительные файлы