Возможности лучевых методов диагностики метастазов в кости кастрационно-резистентного рака предстательной железы (обзор литературы)
- Авторы: Карпова А.А.1, Сергеев Н.И.2, Борисова О.А.2, Никитин П.А.1, Фомин Д.К.2, Солодкий В.А.2
-
Учреждения:
- Научно-исследовательский институт пульмонологии Федерального медико-биологического агентства России
- Российский научный центр рентгенорадиологии Минздрава России
- Выпуск: Том 5, № 4 (2024)
- Страницы: 854-869
- Раздел: Обзоры
- URL: https://bakhtiniada.ru/DD/article/view/309841
- DOI: https://doi.org/10.17816/DD629449
- ID: 309841
Цитировать
Аннотация
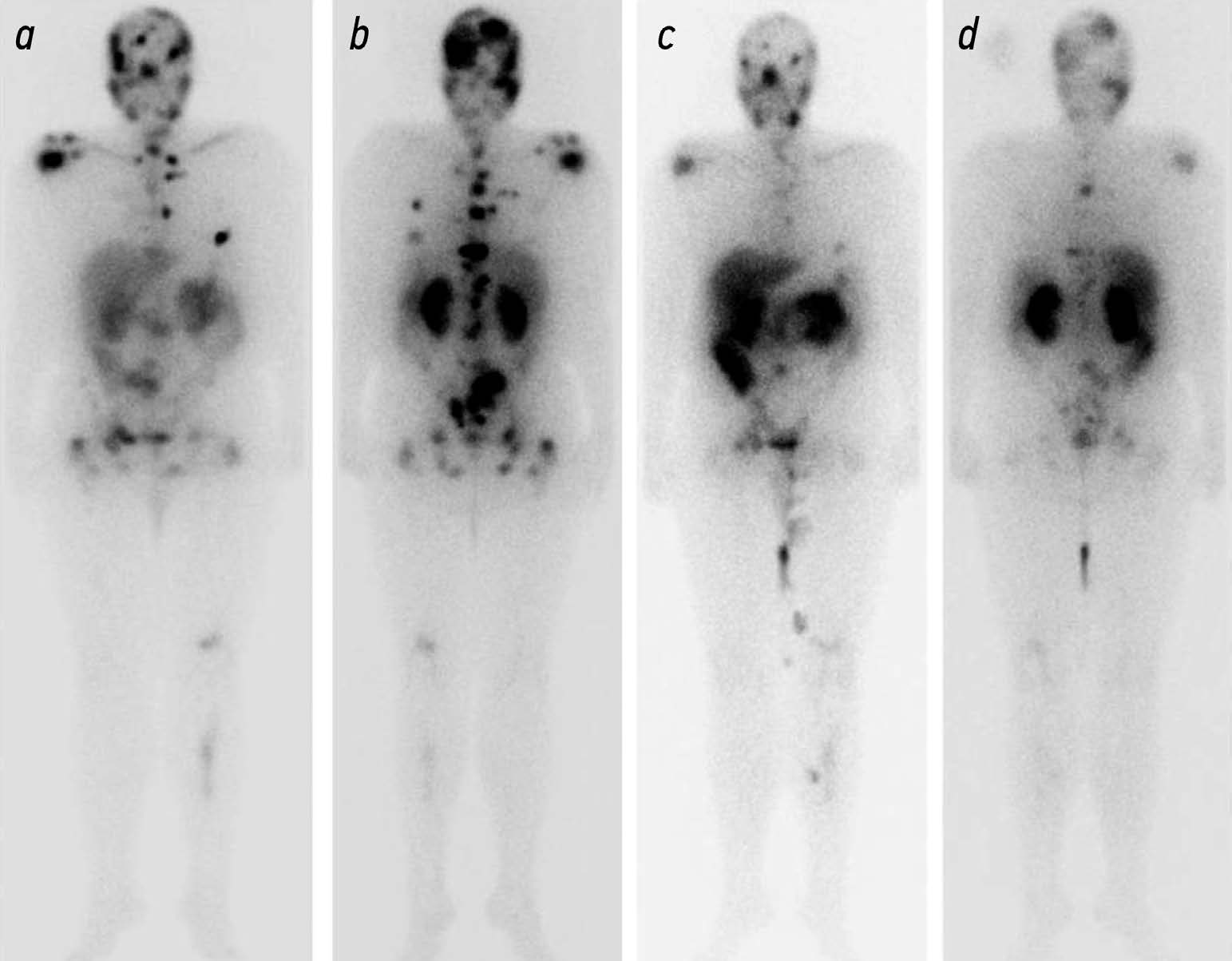
Метастатический кастрационно-резистентный рак предстательной железы (мКРРПЖ) — это прогрессирование опухолевого процесса при формировании невосприимчивости к андроген-депривационной терапии. Частота появления метастазов в костях у таких пациентов достигает 90%. В диагностике мКРРПЖ широко используют лучевые методы исследований. Компьютерная томография и магнитно-резонансная томография обладают преимуществами в анатомической визуализации, однако имеют ограничения в оценке эффективности лечения заболевания. Сцинтиграфию применяют для скрининга метастатического поражения костей скелета, но при этом затруднён анализ прогрессирования заболевания. Позитронно-эмиссионную томографию (ПЭТ), совмещённую с компьютерной томографией, и однофотонную эмиссионную компьютерную томографию используют для раннего выявления местного или системного распространения рака предстательной железы. Информация о количестве поглощённого радиофармпрепарата (РФП) с помощью ПЭТ-визуализации простатоспецифичного мембранного антигена используют для прогнозирования эффективности противоопухолевой терапии. С внедрением в практическую деятельность РФП (177Lu-PSMA) открылась перспектива проведения радионуклидной терапии с одновременным определением её эффективности методами гибридной визуализации. Возможности методов лучевой диагностики метастазов в кости представляют особый интерес для изучения и систематизации получаемых данных и разработки показаний для проведения радиолигандной терапии и анализа её эффективности.
Опубликованные данные свидетельствуют о том, что лучевые методы диагностики мКРРПЖ обладают различной чувствительностью и специфичностью, имеют свои преимущества и недостатки, что говорит о необходимости комплексного подхода в их использовании.
Разработка и развитие методик количественной оценки эффективности лечения, выявление прогностических маркёров позволит грамотно выбрать необходимую тактику лечения и облегчит подбор РФП, что приведёт к увеличению общей выживаемости.
Полный текст
Открыть статью на сайте журналаОб авторах
Анастасия Анатольевна Карпова
Научно-исследовательский институт пульмонологии Федерального медико-биологического агентства России
Автор, ответственный за переписку.
Email: karpovaaadoc@yandex.ru
ORCID iD: 0000-0002-0251-254X
SPIN-код: 9993-5553
врач-рентгенолог отделения лучевой диагностики
Россия, МоскваНиколай Иванович Сергеев
Российский научный центр рентгенорадиологии Минздрава России
Email: sergeevnickolay@yandex.ru
ORCID iD: 0000-0003-4147-1928
SPIN-код: 2408-6502
д-р мед. наук, заведующий лабораторией рентгенорадиологии научно-исследовательского отдела комплексной диагностики заболеваний и радиотерапии
Россия, МоскваОльга Анатольевна Борисова
Российский научный центр рентгенорадиологии Минздрава России
Email: olga250578@yandex.ru
ORCID iD: 0009-0003-7809-0130
SPIN-код: 2416-1885
канд. мед. наук, врач-радиолог, заведующая отделением радионуклидной диагностики клиники ядерной медицины
Россия, МоскваПавел Алексеевич Никитин
Научно-исследовательский институт пульмонологии Федерального медико-биологического агентства России
Email: paul2003@mail.ru
ORCID iD: 0000-0003-1809-6330
SPIN-код: 6257-2399
канд. мед. наук, заведующий отделением лучевой диагностики - врач-рентгенолог
Россия, МоскваДмитрий Кириллович Фомин
Российский научный центр рентгенорадиологии Минздрава России
Email: dkfomin@yandex.ru
ORCID iD: 0000-0002-7316-3519
SPIN-код: 4593-1292
д-р мед. наук, профессор РАН, руководитель клиники ядерной медицины
Россия, МоскваВладимир Алексеевич Солодкий
Российский научный центр рентгенорадиологии Минздрава России
Email: director@rncrr.ru
ORCID iD: 0000-0002-1641-6452
SPIN-код: 9556-6556
д-р мед. наук, профессор, академик РАН, заслуженный врач РФ, директор ФГБУ «Российский научный центр рентгенорадиологии» Минздрава России
Россия, МоскваСписок литературы
- Каприн А.Д., Алексеев Б.Я., Матвеев В.Б., и др. Рак предстательной железы. Клинические рекомендации // Общероссийский национальный союз «Ассоциация онкологов России». 2021. https://oncologyassociation.ru/wpcontent/uploads/2021/02/rpzh.pdf. Дата обращения: 24.03.2024. EDN: RLCXWE
- Gevorkyan A.R., Molodtsov M.S., Aleksandrov E.V. Prostate cancer diagnosis as part of high tech advanced outpatient medical care // Urology Herald. 2023. Vol. 11, N 1. P. 26–33. doi: 10.21886/2308-6424-2023-11-1-26-33
- Ling S.W., de Blois E., Hooijman E., et al. Advances in 177Lu-PSMA and 225Ac-PSMA Radionuclide Therapy for Metastatic Castration Resistant Prostate Cancer // Pharmaceutics. 2022. Vol. 14, N 10. P. 2166. doi: 10.3390/pharmaceutics14102166
- Sekhoacha M., Riet K., Motloung P., et al. Prostate Cancer Review: Genetics, Diagnosis, Treatment Options, and Alternative Approaches // Molecules. 2022. Vol. 27, N 17. P. 5730. doi: 10.3390/molecules27175730
- Солодкий В.А., Павлов А.Ю., Фомин Д.К., и др. Определение роли Лютеция-ПСМА и других препаратов, нацеленных на ПСМА, при раке предстательной железы // Вестник РНЦРР. 2022. Т. 22, № 2. С. 27–36. EDN: UNNDSN
- Медведева А.А., Чернов В.И., Усынин Е.А., и др. Использование 177Lu-ПСМА для радионуклидной терапии у пациентов с кастрационно-резистентным раком предстательной железы // Сибирский онкологический журнал. 2021. Т. 20, № 3. С. 115–123. EDN: DIJSIE doi: 10.21294/1814-4861-2021-20-3-115-123
- Pezaro C., Omlin A., Lorente D., et al. Visceral Disease in Castration-resistant Prostate Cancer // Eur Urol. 2014. Vol. 65, N 2. P. 270–273. doi: 10.1016/j.eururo.2013.10.055
- Clezardin P., Coleman R., Puppo M., et al. Bone metastasis: mechanisms, therapies, and biomarkers // Physiol Rev. 2021. Vol. 101, N 3. P. 797–855. doi: 10.1152/physrev.00012.2019
- Zhang X. Interactions between cancer cells and bone microenvironment promote bone metastasis in prostate cancer // Cancer Commun. 2019. Vol. 39, N 1. P. 76. doi: 10.1186/s40880-019-0425-1
- Hofman M., Lawrentschuk N., Francis R., et al. Prostate-specific membrane antigen PET-CT in patients with high risk prostate cancer before curative intent surgery or radiotherapy (proPSMA): a prospective, randomised, multicentre study // Lancet. 2020. Vol. 395, N 10231. P. 1208–1216. doi: 10.1016/S0140-6736(20)30314-7
- Awenat S., Piccardo A., Carvoeiras P., et al. Diagnostic Role of 18F-PSMA-1007 PET/CT in Prostate Cancer Staging: A Systematic Review // Diagnostics. 2021. Vol. 11, N 3. P. 552. doi: 10.3390/diagnostics11030552
- Alberts I., Sachpekidis C., Fech V., et al. PSMA-negative prostate cancer and the continued value of choline-PET/CT // Nuklearmedizin. 2020. Vol. 59, N 1. P. 33–34. doi: 10.1055/a-1044-1855
- Sartor O., Baghian A. Prostate specific membrane antigen binding radiopharmaceuticals: Current data and new concepts // Front Med (Lausanne). 2022. Vol. 9, 1060922. doi: 10.3389/fmed.2022.1060922
- Plichta K., Graves S., Buatti J. Prostate Specific Membrane Antigen (PSMA) Theranostics for Treatment of Oligometastatic Prostate Cancer // Int J Mol Sci. 2021. Vol. 22, N 22. P. 12095. doi: 10.3390/ijms222212095
- Sun M., Niaz M., Niaz M., et al. Prostate Specific Membrane Antigen (PSMA)-Targeted Radionuclide Therapies for Prostate Cancer // Curr Oncol Rep. 2021. Vol. 23, N 5. P. 59. doi: 10.1007/s11912-021-01042-w
- Alberts I., Sachpekidis C., Dijkstra L., et al. The role of additional late PSMA-ligand PET/CT in the differentiation between lymph node metastases and ganglia // Eur J Nucl Med Mol Imaging. 2020. Vol. 47, N 3. P. 642–651. doi: 10.1007/s00259-019-04552-9
- Khreish F., Ebert N., Ries M., et al. 225Ac-PSMA-617/177Lu-PSMA-617 tandem therapy of metastatic castration-resistant prostate cancer: pilot experience // Eur J Nucl Med Mol Imaging. 2020. Vol. 47, N 3. P. 721–728. doi: 10.1007/s00259-019-04612-0
- Kendrick J., Francis R., Hassan G.M., et al. Radiomics for Identification and Prediction in Metastatic Prostate Cancer: A Review of Studies // Front Oncol. 2021. Vol. 11, P. 771–787. doi: 10.3389/fonc.2021.771787
- Macedo F., Ladeira K., Pinho F., et al. Bone metastases: an overview // Oncol Rev. 2017. Vol. 11, N 1. P. 321. doi: 10.4081/oncol.2017.321
- Kitagawa Y., Yamaoka T., Yokouchi M., et al. Diagnostic Value of Plain Radiography for Symptomatic Bone Metastasis at the First Visit // J Nippon Med Sch. 2018. Vol. 85, N 6. P. 315–321. doi: 10.1272/jnms.JNMS.2018_85-51
- Cornford P., van den Bergh R.C.N., Briers E., et al. EAU-EANM-ESTRO-ESUR-SIOG Guidelines on Prostate Cancer. Part II–2020 Update: Treatment of Relapsing and Metastatic Prostate Cancer // Eur Urol. 2021. Vol. 79, N 2. P. 263–282. doi: 10.1016/j.eururo.2020.09.046
- Liu T., Wang S., Liu H., et al. Detection of vertebral metastases: a meta-analysis comparing MRI, CT, PET, BS and BS with SPECT // J Cancer Res Clin Oncol. 2017. Vol. 143, N 3. P. 457–465. doi: 10.1007/s00432-016-2288-z
- Сергеев Н.И., Котляров П.М., Солодкий В.А. Стандарты анализа метастатического поражения костных структур по данным современных методов лучевой диагностики // Сибирский онкологический журнал. 2018. Т. 17. № 1. С. 5–10. EDN: YQNNKI doi: 10.21294/1814-4861-2018-17-1-5-10
- Chen Z., Chen X., Wang R. Application of SPECT and PET / CT with computer-aided diagnosis in bone metastasis of prostate cancer: a review // Cancer Imaging. 2022. Vol. 22, N 1. P. 18. doi: 10.1186/s40644-022-00456-4
- Steinhauer V., Sergeev N.I. Radiomics in Breast Cancer: In Depth Machine Analysis of MR Images of Metastatic Spine Lesion // Sovrem Tekhnologii Med. 2022. Vol. 14, N 2. P. 16–24. doi: 10.17691/stm2022.14.2.02
- Vilanova J., Garcia Figueiras R., Luna A., et al. Update on Whole-body MRI in Musculoskeletal Applications // Semin Musculoskelet Radiol. 2019. Vol. 23, N 3. P. 312–323. doi: 10.1055/s-0039-1685540
- Padhani A.R., Lecouvet F.E., Tunariu N., et al. Rationale for Modernising Imaging in Advanced Prostate Cancer // Eur Urol Focus. 2017. Vol. 3, N 2–3. P. 223–239. doi: 10.1016/j.euf.2016.06.018
- Карман А.В. Абакумова Е.А., Шиманец С.В., и др. Мультипараметрическая МРТ в диагностике и стадировании рака предстательной железы // Онкологический журнал. 2019. Т. 1, № 49. С. 136–147. EDN: VTNFYB
- Perez Lopez R., Mateo J., Mossop H., et al. Diffusion weighted Imaging as a Treatment Response Biomarker for Evaluating Bone Metastases in Prostate Cancer: A Pilot Study // Radiology. 2017. Vol. 283, N 1. P. 168–177. doi: 10.1148/radiol.2016160646
- Nakanishi K., Tanaka J., Nakaya Y., et al. Whole-body MRI: detecting bone metastases from prostate cancer // Jpn J Radiol. 2022. Vol. 40, N 3. P. 229–244. doi: 10.1007/s11604-021-01205-6
- Sun G., Zhang Y., Liu F., et al. Whole body magnetic resonance imaging is superior to skeletal scintigraphy for the detection of bone metastatic tumors: a meta analysis // Eur Rev Med Pharmacol Sci. 2020. Vol. 24, N 13. P. 7240–7252. doi: 10.26355/eurrev_202007_21879
- Padhani A., Lecouvet F., Tunariu N., et al. METastasis Reporting and Data System for Prostate Cancer: Practical Guidelines for Acquisition, Interpretation, and Reporting of Whole body Magnetic Resonance Imaging based Evaluations of Multiorgan Involvement in Advanced Prostate Cancer // Eur Urol. 2017. Vol. 71, N 1. P. 81–92. doi: 10.1016/j.eururo.2016.05.033
- Van den Wyngaert T., Strobel K., Kampen W., et al. The EANM practice guidelines for bone scintigraphy // Eur J Nucl Med Mol Imaging. 2016. Vol. 43, N 9. P. 1723–1738. doi: 10.1007/s00259-016-3415-4
- Scher H., Morris M., Stadler W., et al. Trial Design and Objectives for Castration Resistant Prostate Cancer: Updated Recommendations From the Prostate Cancer Clinical Trials Working Group 3 // J Clin Oncol. 2016. Vol. 34, N 12. P. 1402–1418. doi: 10.1200/JCO.2015.64.2702
- Anand A., Heller G., Fox J., et al. Automated Bone Scan Index to Optimize Prostate Cancer Working Group Radiographic Progression Criteria for Men With Metastatic Castration Resistant Prostate Cancer // Clin Genitourin Cancer. 2022. Vol. 20, N 3. P. 270–277. doi: 10.1016/j.clgc.2022.02.002
- Chao H., Chang C., Chiu C., et al. Bone Scan Flare Phenomenon in Non–Small–Cell Lung Cancer Patients Treated With Gefitinib // Clin Nucl Med. 2009. Vol. 34, N 6. P. 346–349. doi: 10.1097/RLU.0b013e3181a344df
- van der Zande K., Oyen W.J.G., Zwart W., et al. Radium 223 Treatment of Patients with Metastatic Castration Resistant Prostate Cancer: Biomarkers for Stratification and Response Evaluation // Cancers (Basel). 2021. Vol. 13, N 17. P. 4346. doi: 10.3390/cancers13174346
- Nakajima K., Edenbrandt L., Mizokami A. Bone scan index: A new biomarker of bone metastasis in patients with prostate cancer // Int J Urol. 2017. Vol. 24, N 9. P. 668–673. doi: 10.1111/iju.13386
- Ruchalski K., Dewan R., Sai V., et al. Imaging response assessment for oncology: An algorithmic approach // Eur J Radiol Open. 2022. Vol. 9, P. 100426. doi: 10.1016/j.ejro.2022.100426
- Еременко А.В., Косых Н.Э., Разуваев В.А., Савин С.З. Исследование возможностей компьютерного автоматизированного анализа для задач эффективной диагностики диссеминированного рака предстательной железы // Лучевая диагностика и терапия. 2019. № 1. С. 74–85. EDN: NQOKHZ doi: 10.22328/2079-5343-2019-10-1-74-85
- Dennis E., Jia X., Mezheritskiy I., et al. Bone Scan Index: A Quantitative Treatment Response Biomarker for Castration Resistant Metastatic Prostate Cancer // J Clin Oncol. 2012. Vol. 30, N 5. P. 519–524. doi: 10.1200/JCO.2011.36.5791
- Sheikhbahaei S., Jones K., Werner R., et al. 18F-NaF-PET/CT for the detection of bone metastasis in prostate cancer: a meta analysis of diagnostic accuracy studies // Ann Nucl Med. 2019 Vol. 33, N 5. P. 351–361. doi: 10.1007/s12149-019-01343-y
- Shen G., Deng H., Hu S., et al. Comparison of choline-PET/CT, MRI, SPECT, and bone scintigraphy in the diagnosis of bone metastases in patients with prostate cancer: a meta-analysis // Skeletal Radiol. 2014. Vol. 43, N 11. P. 1503–1513. doi: 10.1007/s00256-014-1903-9
- Сергеев Н.И., Фомин Д.К., Котляров П.М., и др. Сравнительное исследование возможностей остеосцинтиграфии и магнитно- резонансной томографии всего тела в диагностике костных метастазов // Медицинская Визуализация. 2014. Т. 4. С. 107–113. EDN: SNIDQB
- Blackwell W. Radiology Nuclear Medicine Diagnostic Imaging: A Correlative Approach. First. ed. Gholamrezanezhad A., Assadi M., Jadvar H., editors. USA. 2023.
- Mohd Rohani M., Mat Nawi N., Shamim S., et al. Maximum standardized uptake value from quantitative bone single photon emission computed tomography/computed tomography in differentiating metastatic and degenerative joint disease of the spine in prostate cancer patients // Ann Nucl Med. 2020. Vol. 34, N 1. P. 39–48. doi: 10.1007/s12149-019-01410-4
- Okamoto S., Thieme A., Allmann J., et al. Radiation Dosimetry for 177Lu-PSMA I&T in Metastatic Castration Resistant Prostate Cancer: Absorbed Dose in Normal Organs and Tumor Lesions // J Nucl Med. 2017. Vol. 58, N 3. P. 445–450. doi: 10.2967/jnumed.116.178483
- Ghodsirad M., Pirayesh E., Akbarian R., et al. Diagnostic Utility of Lutetium-177 (Lu 177) Prostate Specific Membrane Antigen (PSMA) Scintigraphy In Prostate Cancer Patients With PSA Rise And Negative Conventional Imaging // Urol J. 2020. Vol. 17, N 4. P. 374–378. doi: 10.22037/uj.v0i0.5451
- Venkatachalapathy V., Rajeshkannan R., Sarma M., et al. Comparison of whole body bone scintigraphy with axial skeleton magnetic resonance imaging in the skeletal evaluation of carcinoma prostate // Indian J Urol. 2021. Vol. 37, N 1. P. 72–78. doi: 10.4103/iju.IJU_238_20
- Сергеев Н.И., Фомин Д.К., Котляров П.М., Солодкий В.А.. Сравнительное исследование возможностей ОФЭКТ/КТ и магнитно-резонансной томографии всего тела в диагностике костных метастазов // Вестник российского научного центра рентгенорадиологии. 2015. Т. 15, № 3. С. 8. EDN: UXMAVX
- Li R., Ravizzini G., Gorin M., et al. The use of PET/CT in prostate cancer // Prostate Cancer Prostatic Dis. 2018. Vol. 21, N 1. P. 4–21. doi: 10.1038/s41391-017-0007-8
- Azad G., Cook G. Multi technique imaging of bone metastases: spotlight on PET-CT // Clin Radiol. 2016. Vol. 71, N 7. P. 620–631. doi: 10.1016/j.crad.2016.01.026
- Kannivelu A., Loke K., Kok T., et al. The Role of PET/CT in the Evaluation of Skeletal Metastases // Semin Musculoskelet Radiol. 2014. Vol. 18, N 2. P. 149–165. doi: 10.1055/s-0034-1371017
- Jadvar H. Molecular Imaging of Prostate Cancer: PET Radiotracers // AJR Am J Roentgenol. 2012. Vol. 199, N 2. P. 278–291. doi: 10.2214/AJR.12.8816
- Alam M., Singh S., Thapaliya S., et al. A Review of 177Lutetium-PSMA and 225Actinium-PSMA as Emerging Theranostic Agents in Prostate Cancer // Cureus. 2022. Vol. 14, N 9. P. 29369. doi: 10.7759/cureus.29369
- Eisenhauer E., Therasse P., Bogaerts J., et al. New response evaluation criteria in solid tumours: Revised RECIST guideline (version 1.1) // Eur J Cancer. 2009. Vol. 45, N 2. P. 228–247. doi: 10.1016/j.ejca.2008.10.026
- Acar E., Özdoğan Ö., Aksu A., et al. The use of molecular volumetric parameters for the evaluation of Lu-177 PSMA I&T therapy response and survival // Ann Nucl Med. 2019. Vol. 33, N 9. P. 681–688. doi: 10.1007/s12149-019-01376-3
- Maffey Steffan J., Scarpa L., Svirydenka A., et al. The 68Ga/177Lu theragnostic concept in PSMA-targeting of metastatic castration resistant prostate cancer: impact of post therapeutic whole body scintigraphy in the follow up // Eur J Nucl Med Mol Imaging. 2020. Vol. 47, N 3. P. 695–712. doi: 10.1007/s00259-019-04583-2
- O J., Lodge M., Wahl R. Practical PERCIST: A Simplified Guide to PET Response Criteria in Solid Tumors 1.0 // Radiology. 2016. Vol. 280, N 2. P. 576–584. doi: 10.1148/radiol.2016142043
- Schmuck S., von Klot C., Henkenberens C., et al. Initial Experience with Volumetric 68 Ga-PSMA I&T PET/CT for Assessment of Whole-Body Tumor Burden as a Quantitative Imaging Biomarker in Patients with Prostate Cancer // Journal of Nuclear Medicine. 2017. Vol. 58, N 12. P. 1962–1968. doi: 10.2967/jnumed.117.193581
- Tanaka K., Norikane T., Mitamura K., et al. Quantitative [99mTc]Tc-MDP SPECT/CT correlated with [18F]NaF PET/CT for bone metastases in patients with prostate cancer // EJNMMI Phys. 2022. Vol. 9, N 1. P. 83. doi: 10.1186/s40658-022-00513-8
- Vlachostergios P., Niaz M., Sun M., et al. Prostate-Specific Membrane Antigen Uptake and Survival in Metastatic Castration-Resistant Prostate Cancer // Front Oncol. 2021. Vol. 11, P. 630589. doi: 10.3389/fonc.2021.630589
- Beyersdorff D., Rahbar K., Essler M., et al. Interdisziplinärer Expertenkonsensus zu Innovationen der bildgebenden Diagnostik und radionuklidbasierten Therapien des fortgeschrittenen Prostatakarzinoms // Urologe. 2021. Vol. 60, P. 1579–1585. doi: 10.1007/s00120-021-01598-2
- Gafita A., Rauscher I., Weber M., et al. Novel Framework for Treatment Response Evaluation Using PSMA PET/CT in Patients with Metastatic Castration-Resistant Prostate Cancer (RECIP 1.0): An International Multicenter Study // J Nucl Med. 2022. Vol. 63, N 11. P. 1651–1658. doi: 10.2967/jnumed.121.263072
- Isaac A., Dalili D., Dalili D., Weber M. State of the art imaging for diagnosis of metastatic bone disease // Radiologe. 2020. Vol. 60, N 1. P. 1–16. doi: 10.1007/s00117-020-00666-6
Дополнительные файлы