Реакция производного тетрагидропиримидин-2(1Н)-тиона с тиолсодержащими гидразидами как метод синтеза биологически активных лигандов гликонаночастиц золота
- Авторы: Ершов А.Ю.1, Лагода И.В.2, Мартыненков А.А.1, Батыренко А.А.2
-
Учреждения:
- Институт высокомолекулярных соединений РАН
- Государственный научно-исследовательский испытательный институт военной медицины Минобороны РФ
- Выпуск: Том 60, № 2-3 (2024)
- Страницы: 167–169
- Раздел: Статьи
- URL: https://bakhtiniada.ru/0514-7492/article/view/274703
- DOI: https://doi.org/10.31857/S0514749224020041
- EDN: https://elibrary.ru/EKGZQO
- ID: 274703
Цитировать
Полный текст
Аннотация
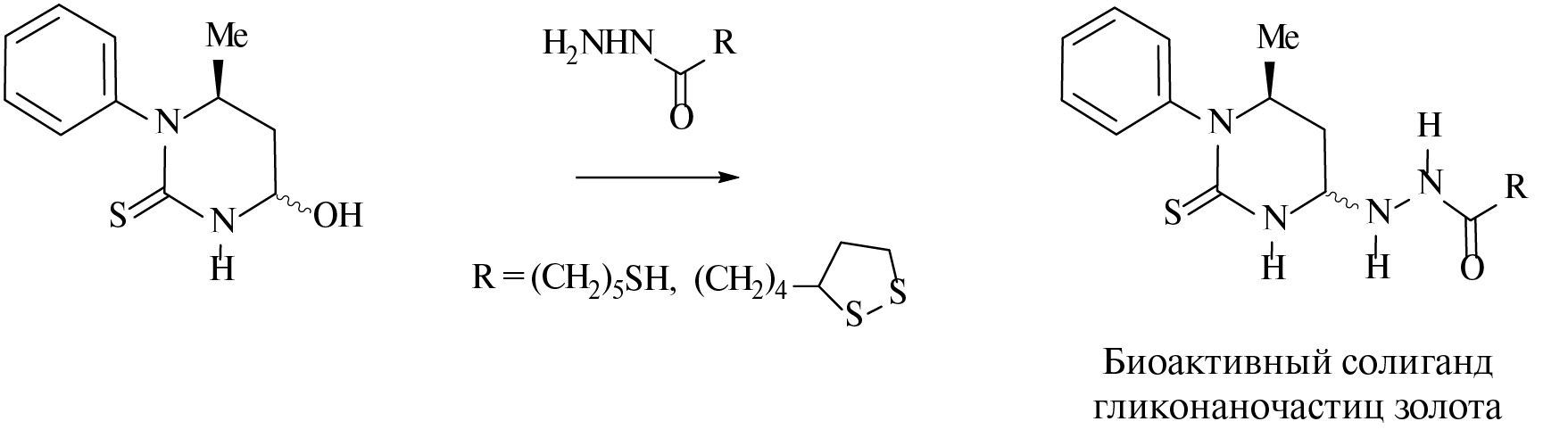
Взаимодействие 4-гидрокси-1-фенил-6-метилтетрагидропиримидин-2(1Н)-тиона с гидразидами 6-меркаптогексановой и липоевой (тиоктовой) кислот с выходами 60–75% приводит к образованию 4-[(ω-меркаптоацил)гидразино]-1-фенил-6-метилтетрагидропиримидин-2(1Н)-тионов — перспективных солигандов для получения гликонаночастиц золота биомедицинского назначения.
Полный текст
Тетрагидропиримидин-2(1Н)-тионы — продукты взаимодействия непредельных карбонильных соединений с производными тиомочевины — успешно находят свое применение в онкологии при разработке современных противоопухолевых препаратов [1].
Биологическая активность таких препаратов должна существенно возрастать при условии их адресной доставки в пораженный орган или ткань живого организма. Одним из способов доставки может являться иммобилизация производных пиримидин-2(1Н)-тиона на поверхности наночастицы в качестве солиганда [2]. Данные супрамолекулярные объекты способны моделировать естественную клеточную поверхность и избирательно вступать в комплементарное взаимодействие с поверхностными клеточными рецепторами (лектинами), что обеспечивает целевую доставку лекарственного вещества, иммобилизированного на их поверхности [3–5].
Схема
Мы обнаружили, что взаимодействие 4-гидрокси-1-фенил-6-метилтетрагидропиримидин-2(1Н)-тиона 1 с гидразидами 6-меркаптогексановой и липоевой (тиоктовой) кислот проходит после непродолжительного кипячения эквимолярных количеств исходных соединений в MeOH в присутствии каталитических количеств АсОН и приводит к образованию целевых продуктов 2а,b с выходами 60–75% (схема).
Циклическое пиримидиновое строение соединений 2а,b не вызывает сомнений, о чем можно судить на основании данных ЯМР 1Н и 13С спектроскопии. Характерным спектральным признаком пиримидинового строения соединений 2а,b в спектрах ЯМР 13С является заметное сильнопольное смещение сигнала атома углерода С4 – 64.80 м.д. (N–C–N-окружение) по сравнению с аналогичным сигналом атома углерода исходного соединения 1 – 70.57 м.д. (N–C–О-окружение) [6].
Спектры ЯМР 1Н и 13С снимали на спектрометре Bruker AC-400 (400 и 100 МГц соответственно). Соединение 1 получено по известной методике [6].
4-[(6-Меркаптогексаноил)гидразино]-1-фенил-6-метилтетрагидропиримидин-2(1Н)-тион 2a. Выход: 60%, т.пл. 74–76°С. Спектр ЯМР 1Н (ДМСО-d6), δ, м.д.: 1.01 д (3Н, СН3, J 6.5 Гц), 1.35 м (2Н, СН2), 1.50 м (2Н, СН2), 1.59 м (2Н, СН2), 1.99 м (1H, Н5), 2.01 т (1Н, SН, J 7.0 Гц), 2.14 м (1Н, Н5), 2.27 м (2Н, СН2), 2.48 к (2Н, СН2S, J 7.0 Гц), 3.83 м (1Н, Н6), 4.33 м (1Н, Н4), 5.57 уш.с (1Н, NН), 7.14–7.36 м (5Н, Ar), 8.26 уш.с (1Н, NH), 9.42 уш.с (1Н, NНСО). Спектр ЯМР 13С (ДМСО-d6), δС, м.д.: 19.49 (СН3), 24.77 (СН2), 24.89 (СН2), 27.39 (СН2), 31.60 (СН2), 33.36 (СН2), 37.80 (С5), 52.70 (С6), 64.79 (С4), 126.82, 128.55, 129.15, 144.62 (Ar), 172.94 (С=О), 177.36 (C2). Найдено, %: C 55.67; H 7.21; N 15.35. C17H26N4OS2. Вычислено, %: C 55.70, H 7.15, N 15.29.
4-[(1,2-Дитиолан-3-пентаноил)гидразино]-1-фенил-6-метилтетрагидропиримидин-2(1Н)-тион 2b. Выход: 75%, т.пл. 173–175°С. Спектр ЯМР 1Н (ДМСО-d6), δ, м.д.: 1.02 д (3Н, СН3, J 6.5 Гц), 1.39 м (2Н, СН2), 1.56–1.67 м (4Н, 2СН2), 1.89 м (1Н, Н5), 2.09 м (1H, Н5), 2.12 м (2Н, СН2), 2.39 м (2Н, СН2), 3.12 м (2Н, СН2), 3.62 м (1Н, СН), 3.93 м (1Н, Н6), 4.33 м (1Н, Н4), 5.58 уш.с (1Н, NН), 7.14–7.38 м (5Н, Ar), 8.25 уш.с (1Н, NH), 9.43 уш.с (1Н, NНСО). Спектр ЯМР 13С (ДМСО-d6), δС, м. д.: 19.48 (СН3), 24.91 (СН2), 28.24 (СН2), 33.27 (СН2), 34.15 (СН2), 38.97 (С5), 40.01 (СН2), 52.34 (С6), 56.20 (СН), 64.81 (С4), 126.80, 128.54, 129.14, 144.61 (Ar), 172.93 (С=О), 177.34 (C2). Найдено, %: C 53.69; H 6.71; N 13.23. C19H28N4OS3. Вычислено, %: C 53.74; H 6.65; N 13.19.
ЗАКЛЮЧЕНИЕ
Целевые соединения 2а,b могут представлять интерес в качестве биоактивных солигандов для получения гликонаночастиц золота — перспективных средств адресной доставки, диагностики и лечения ряда онкологических заболеваний, содержащих в своем составе пиримидиновые фрагменты [2–5].
КОНФЛИКТ ИНТЕРЕСОВ
Авторы статьи заявляют об отсутствии конфликта интересов.
Об авторах
Андрей Юрьевич Ершов
Институт высокомолекулярных соединений РАН
Автор, ответственный за переписку.
Email: ershov305@mail.ru
ORCID iD: 0000-0002-2266-4380
Россия, 199004 Санкт-Петербург, В.О., Большой просп., 31
Игорь Викторович Лагода
Государственный научно-исследовательский испытательный институт военной медицины Минобороны РФ
Email: ershov305@mail.ru
ORCID iD: 0000-0002-3906-2909
Россия, 195043 Санкт-Петербург, Лесопарковая ул., 4
Александр Алексеевич Мартыненков
Институт высокомолекулярных соединений РАН
Email: ershov305@mail.ru
ORCID iD: 0000-0002-0951-1451
Россия, 199004 Санкт-Петербург, В.О., Большой просп., 31
Алина Александровна Батыренко
Государственный научно-исследовательский испытательный институт военной медицины Минобороны РФ
Email: ershov305@mail.ru
ORCID iD: 0000-0001-9688-3650
Россия, 195043 Санкт-Петербург, Лесопарковая ул., 4
Список литературы
- Sanchez-Sancho F., Escolano M., Gavina D., Csaky A.G., Sanchez-Rosello M., Diaz-Oltra S., del Pozo C. Pharmaceuticals. 2022, 15, 948. doi: 10.3390/ph15080948
- Amina S.J., Guo B. Inter. J. Nanomed. 2020, 15, 9823–9857. doi: 10.2147/ijn.s279094
- Nanobiomaterials in Cancer Therapy: Applications of Nanobiomaterials. Ed. A.M. Grumezescu. Amsterdam, Boston et al.: William Andrew, Elsevier, 7, 2016. doi: 10.1016/B978-0-323-42863-7.00002-5
- Engineered Carbohydrate-Based Materials for Biomedical Applications: Polymers, Surfaces, Dendrimers, Nanoparticles, and Hydrogels. Ed. R. Narain. New Jersey: John Wiley & Sons, 2011. doi: 10.1002/9780470944 349.ch6
- Ершов А.Ю., Мартыненков А.А., Лагода И.В., Батыренко А.А., Драчев И.С., Якунчикова Е.А., Федорос Е.И., Круглов С.С., Копаница М.А., Якиманский А.В. ЖОХ. 2022, 92, 788–798. [Ershov A.Yu., Martynenkov A.A., Lagoda I.V., Batyrenko A.A., Drachev I.S., Yakunchikova E.A., Fedoros E.I., Kruglov S.S., Kopanitsa M.A., Yakimansky A.V. Russ. J. Gen. Chem. 2022, 92, 850–859.] doi: 10.1134/S1070363222050140
- Алексеев В.В., Якимович С.И., Зерова И.В., Егорова М.Б., Синкконен Я. ХГС. 2014, 10, 1606–1617. [Alekseyev V.V., Yakimovich S.I., Zerova I.V., Egorova M.B., Sinkkonen J. Chem. Heterocycl. Com. 2014, 49, 1490–1499.] doi: 10.1007/s10593-014-1400-z
Дополнительные файлы