Саркопения: современные подходы к решению диагностических задач
- Авторы: Сморчкова А.К.1, Петряйкин А.В.1, Семенов Д.С.1, Шарова Д.Е.1
-
Учреждения:
- Научно-практический клинический центр диагностики и телемедицинских технологий
- Выпуск: Том 3, № 3 (2022)
- Страницы: 196-211
- Раздел: Обзоры
- URL: https://bakhtiniada.ru/DD/article/view/110721
- DOI: https://doi.org/10.17816/DD110721
- ID: 110721
Цитировать
Аннотация
Саркопения является относительно новым диагнозом для медицинской статистики и системы здравоохранения, и тем не менее представляет социальное и экономическое бремя для системы здравоохранения из-за большого количества возможных неблагоприятных исходов, таких как повышение риска падений, физическая инвалидизация, увеличение времени пребывания в стационаре и увеличение смертности.
Несмотря на то, что узкоспециализированного медикаментозного лечения для саркопении не существует, профилактика и своевременное немедикаментозное лечение помогут снизить риск потенциальных неблагоприятных последствий.
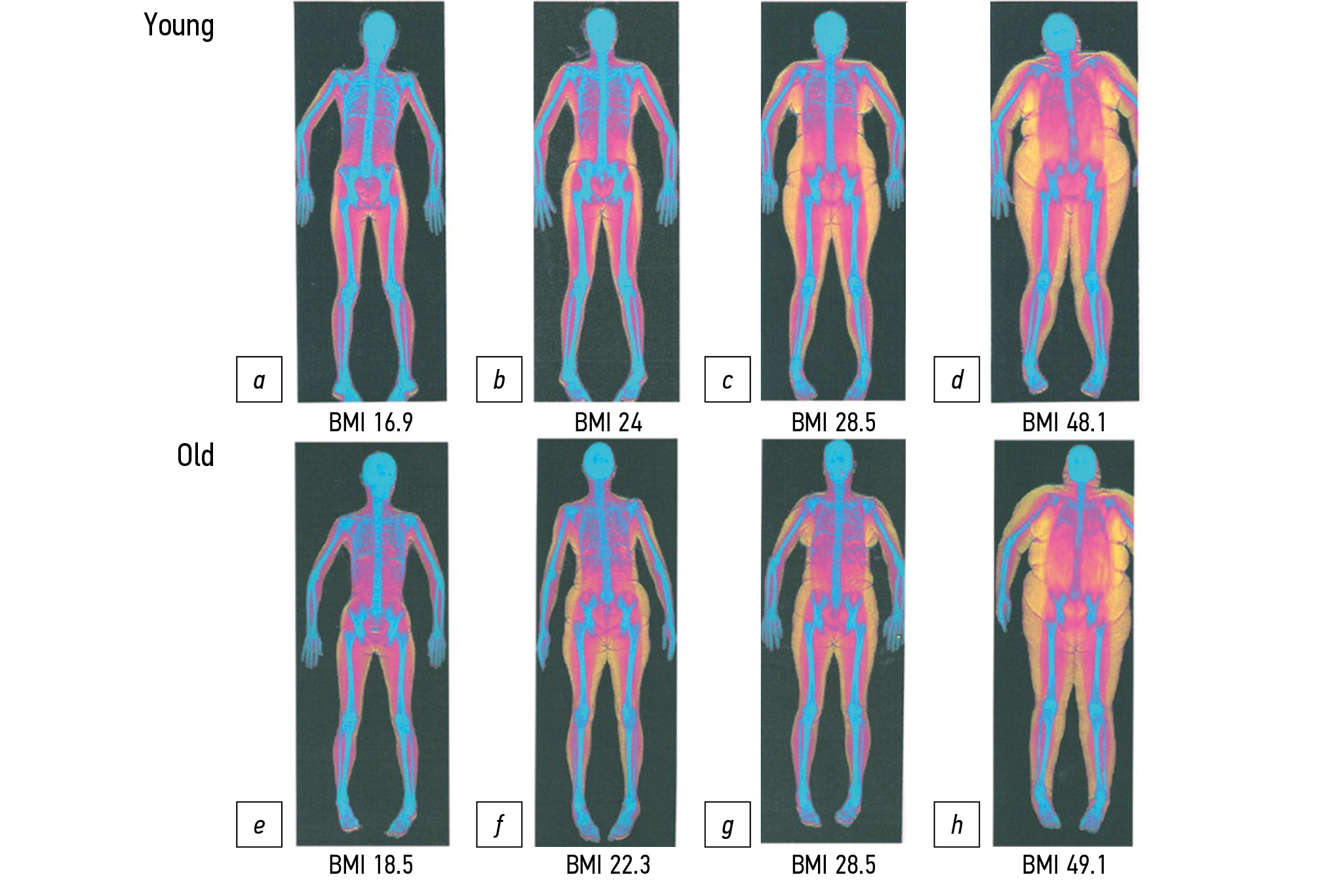
Для установки диагноза саркопении необходимо подтверждение снижения не только мышечной силы, но и мышечной массы. Инструментальная диагностика включает в себя такие методы, как двухэнергетическая рентгеновская абсорбциометрия и биоимпедансометрия. Дополнением к этим методам могут быть алгоритмы искусственного интеллекта для автоматической сегментации мышечной и жировой ткани на компьютерно-томографических и магнитно-резонансных изображениях с последующим расчётом скелетно-мышечного индекса на уровне L3 позвонка. Такое программное обеспечение при его использовании в структурах, подобных Единому радиологическому информационному сервису Единой медицинской информационно-аналитической системы г. Москвы, открывает возможности для оппортунистического скрининга. Тем не менее общепризнанных количественных значений L3 скелетно-мышечного индекса для компьютерно-томографической и магнитно-резонансной диагностики саркопении пока не существует, несмотря на признание данных методик золотым стандартом Европейской рабочей группой по саркопении у пожилых людей. В дополнение к этому существует проблема унификации термина «скелетно-мышечный индекс».
При решении указанных проблем с помощью дальнейших популяционных исследований станет возможным получение новой методики инструментальной диагностики саркопении с последующим её применением для скрининга данного патологического состояния.
Ключевые слова
Полный текст
Открыть статью на сайте журналаОб авторах
Анастасия Кирилловна Сморчкова
Научно-практический клинический центр диагностики и телемедицинских технологий
Email: a.smorchkova@npcmr.ru
ORCID iD: 0000-0002-9766-3390
SPIN-код: 4345-8568
Scopus Author ID: 57213145638
Россия, Москва
Алексей Владимирович Петряйкин
Научно-практический клинический центр диагностики и телемедицинских технологий
Email: alexeypetraikin@gmail.com
ORCID iD: 0000-0003-1694-4682
SPIN-код: 6193-1656
д.м.н.
Россия, МоскваДмитрий Сергеевич Семенов
Научно-практический клинический центр диагностики и телемедицинских технологий
Email: d.semenov@npcmr.ru
ORCID iD: 0000-0002-4293-2514
SPIN-код: 2278-7290
Scopus Author ID: 57213154475
ResearcherId: P-5228-2017
Россия, Москва
Дарья Евгеньевна Шарова
Научно-практический клинический центр диагностики и телемедицинских технологий
Автор, ответственный за переписку.
Email: d.sharova@npcmr.ru
ORCID iD: 0000-0001-5792-3912
SPIN-код: 1811-7595
Россия, Москва
Список литературы
- Cruz-Jentoft A.J., Bahat G., Bauer J., et al. Sarcopenia: revised European consensus on definition and diagnosis // Age and Ageing. 2018. Vol. 48, N 1. P. 16–31. doi: 10.1093/ageing/afy169
- Ткачева О.Н., Котовская Ю.В., Рунихина Н.К., и др. Клинические рекомендации «Старческая астения» // Российский журнал гериатрической медицины. 2020. № 1. С. 11–46. doi: 10.37586/2686-8636-1-2020-11-46
- Bischoff-Ferrari H.A., Orav J.E., Kanis J.A., et al. Comparative performance of current definitions of sarcopenia against the prospective incidence of falls among community-dwelling seniors age 65 and older // Osteoporosis Int. 2015. Vol. 26, N 12. P. 2793–2802. doi: 10.1007/s00198-015-3194-y
- da Silva Alexandre T., de Oliveira Duarte Y.A., Ferreira Santos J.L., et al. Sarcopenia according to the European Working Group on sarcopenia in older people (EWGSOP) versus dynapenia as a risk factor for disability in the elderly // J Nutr Health Aging. 2014. Vol. 18, N 5. P. 547–553. doi: 10.1007/s12603-014-0465-9
- Sousa A.S., Guerra R.S., Fonseca I., et al. Sarcopenia and length of hospital stay // Eur J Clin Nutr. 2015. Vol. 70, N 5. P. 595–601. doi: 10.1038/ejcn.2015.207
- Faulkner J.A., Larkin L.M., Claflin D.R., Brooks S.V. Age-related changes in the structure and function of skeletal muscles // Clin Exp Pharmacol Physiol. 2007. Vol. 34, N 11. P. 1091–1096. doi: 10.1111/j.1440-1681.2007.04752.x
- Shafiee G., Keshtkar A., Soltani A., et al. Prevalence of sarcopenia in the world: a systematic review and meta-analysis of general population studies // J Diabetes Metab Disord. 2017. Vol. 16. P. 21. doi: 10.1186/s40200-017-0302-x
- Petermann-Rocha F., Balntzi V., Gray S.R., et al. Global prevalence of sarcopenia and severe sarcopenia: a systematic review and meta-analysis // J Cachexia Sarcopenia Muscle. 2021. Vol. 13, N 1. P. 86–99. doi: 10.1002/jcsm.12783
- Сафонова Ю.A., Зоткин Е.Г. Саркопения у пациенток старшего возраста с остеоартритом крупных суставов // Научно-практическая ревматология. 2019. Т. 57, № 2. С. 154–159. doi: 10.14412/1995-4484-2019-154-159
- Tsekoura M., Kastrinis A., Katsoulaki M., et al. Sarcopenia and its impact on quality of life // Adv Exp Med Biol. 2017. Vol. 987. P. 213–218. doi: 10.1007/978-3-319-57379-3_19
- Sepúlveda-Loyola W., Osadnik C., Phu S., et al. Diagnosis, prevalence, and clinical impact of SARCOPENIA IN COPD: a systematic review and meta-analysis // J Cachexia Sarcopenia Muscle. 2020. Vol. 11, N 5. P. 1164–1176. doi: 10.1002/jcsm.12600
- Nipp R.D., Fuchs G., El-Jawahri A., et al. Sarcopenia is associated with quality of life and depression in patients with advanced cancer // Oncologist. 2017. Vol. 23, N 1. P. 97–104. doi: 10.1634/theoncologist.2017-0255
- Beaudart C., Biver E., Reginster J.Y., et al. Development of a self-administrated quality of life questionnaire for sarcopenia in elderly subjects: the SarQol // Age Ageing. 2015. Vol. 44, N 6. P. 960–966. doi: 10.1093/ageing/afv133
- Geerinck A., Bruyère O., Locquet M., et al. Evaluation of the responsiveness of the SARQOL® questionnaire, a patient-reported outcome measure specific to sarcopenia // Adv Ther. 2018. Vol. 35, N 11. P. 1842–1858. doi: 10.1007/s12325-018-0820-z
- Geerinck A., Locquet M., Bruyère O., et al. Evaluating quality of life in frailty: applicability and clinimetric properties of the SARQOL questionnaire // J Cachexia Sarcopenia Muscle. 2021. Vol. 12, N 2. P. 319–330. doi: 10.1002/jcsm.12687
- Witham M.D., Heslop P., Dodds R.M., et al. Performance of the SARQOL quality of life tool in a UK population of older people with probable sarcopenia and implications for use in clinical trials: findings from the SARCNET registry // BMC Geriatrics. 2022. Vol. 22, N 1. P. 368. doi: 10.1186/s12877-022-03077-5
- Сафонова Ю.A., Лесняк О.М., Баранова И.А., и др. Русский перевод и валидация SarQoL ― опросника качества жизни для пациентов с саркопенией // Научно-практическая ревматология. 2019. Т. 57, № 1. С. 38–45.
- Gani F., Buettner S., Margonis G.A., et al. Sarcopenia predicts costs among patients undergoing major abdominal operations // Surgery. 2016. Vol. 160, N 5. P. 1162–1171. doi: 10.1016/j.surg.2016.05.002
- Bruyère O., Beaudart C., Ethgen O., et al. The health economics burden of sarcopenia: a systematic review // Maturitas. 2019. Vol. 119. P. 61–69. doi: 10.1016/j.maturitas.2018.11.003
- Peterson M.D., Rhea M.R., Sen A., Gordon P.M. Resistance exercise for muscular strength in older adults: a meta-analysis // Ageing Res Rev. 2010. Vol. 9, N 3. P. 226–237. doi: 10.1016/j.arr.2010.03.004
- McKendry J., Currier B.S., Lim C., et al. Nutritional supplements to support resistance exercise in countering the sarcopenia of aging // Nutrients. 2020. Vol. 12, N 7. P. 2057. doi: 10.3390/nu12072057
- Robinson S.M., Reginster J.Y., Rizzoli R., et al. Does nutrition play a role in the prevention and management of sarcopenia? // Clin Nutr. 2018. Vol. 37, N 4. P. 1121–1132. doi: 10.1016/j.clnu.2017.08.016
- Lozano-Montoya I., Correa-Pérez A., Abraha I., et al. Nonpharmacological interventions to treat physical frailty and sarcopenia in older patients: a systematic overview ― the senator Project Ontop series // Clin Interv Aging. 2017. Vol. 12. P. 721–740. doi: 10.2147/CIA.S132496
- Lappe J.M., Binkley N. Vitamin D and Sarcopenia/Falls // J Clin Densitometry. 2015. Vol. 18, N 4. P. 478–482.
- Rooks D., Roubenoff R. Development of pharmacotherapies for the treatment of sarcopenia // J Frailty Aging. 2019. P. 1–11. doi: 10.14283/jfa.2019.11
- Morley J.E., Abbatecola A.M., Argiles J.M., et al. Sarcopenia with limited mobility: an international consensus // J Am Med Dir Assoc. 2011. Vol. 12, N 6. P. 403–409. doi: 10.1016/j.jamda.2011.04.014
- Malmstrom T.K., Miller D.K., Simonsick E.M., et al. SARC-F: a symptom score to predict persons with sarcopenia at risk for poor functional outcomes // J Cachexia Sarcopenia Muscle. 2015. Vol. 7, N 1. P. 28–36. doi: 10.1002/jcsm.12048
- Bahat G., Yilmaz O., Kiliç C., et al. Performance of SARC-F in regard to sarcopenia definitions, muscle mass and functional measures // J Nutr Health Aging. 2018. Vol. 22, N 8. P. 898–903. doi: 10.1007/s12603-018-1067-8
- Porto J.M., Nakaishi A.P., Cangussu-Oliveira L.M., et al. Relationship between grip strength and global muscle strength in community-dwelling older people // Arch Gerontol Geriatr. 2019. Vol. 82. P. 273–278. doi: 10.1016/j.archger.2019.03.005
- Maggio M., Ceda G.P., Ticinesi A., et al. Instrumental and non-instrumental evaluation of 4-meter walking speed in older individuals // PLoS One. 2016. Vol. 11, N 4. P. e0153583. doi: 10.1371/journal.pone.0153583
- Podsiadlo D., Richardson S. The timed “Up & go”: a test of basic functional mobility for frail elderly persons // J Am Geriatr Soc. 1991. Vol. 39, N 2. P. 142–148. doi: 10.1111/j.1532-5415.1991.tb01616.x
- Beaudart C., McCloskey E., Bruyère O., et al. Sarcopenia in daily practice: assessment and management // BMC Geriatrics. 2016. Vol. 16, N 1. P. 170. doi: 10.1186/s12877-016-0349-4
- Stringer H.J., Wilson D. The role of ultrasound as a diagnostic tool for sarcopenia // J Frailty Aging. 2018. Vol. 7, N 4. P. 258−261. doi: 10.14283/jfa.2018.24
- Петряйкин А.В., Смолярчук М.Я., Петряйкин Ф.А., и др. Оценка точности денситометрических исследований. Применение фантома РСК ФК2 // Травматология и ортопедия России. 2019. Т. 25, № 3. С. 124–134. doi: 10.21823/2311-2905-2019-25-3-124-134
- Shen W., Punyanitya M., Wang Z., et al. Total body skeletal muscle and adipose tissue volumes: estimation from a single abdominal cross-sectional image // J Appl Physiol (1985). 2004. Vol. 97, N 6. P. 2333–2338. doi: 10.1152/japplphysiol.00744.2004
- Mourtzakis M., Prado C.M., Lieffers J.R., et al. A practical and precise approach to quantification of body composition in cancer patients using computed tomography images acquired during routine care // Appl Physiol Nutr Metab. 2008. Vol. 33, N 5. P. 997–1006. doi: 10.1139/H08-075
- Kim E.Y., Kim Y.S., Park I., et al. Prognostic significance of CT-determined sarcopenia in patients with small-cell lung cancer // J Thorac Oncol. 2015. Vol. 10, N 12. P. 1795–1799. doi: 10.1097/JTO.0000000000000690
- Baracos V., Kazemi-Bajestani S.M. Clinical outcomes related to muscle mass in humans with cancer and catabolic illnesses // Int J Biochem Cell Biol. 2013. Vol. 45, N 10. P. 2302–2308. doi: 10.1016/j.biocel.2013.06.016
- Franceschi C., Garagnani P., Morsiani C., et al. The continuum of aging and age-related diseases: common mechanisms but different rates // Front Med (Lausanne). 2018. Vol. 5. P. 61. doi: 10.3389/fmed.2018.00061
- Ferrucci L., Fabbri E. Inflammageing: chronic inflammation in ageing, cardiovascular disease, and frailty // Nature Rev Cardiol. 2018. Vol. 15, N 9. P. 505–522. doi: 10.1038/s41569-018-0064-2
- Zamboni M., Rubele S., Rossi A.P. Sarcopenia and obesity // Curr Opin Clin Nutr Metab Care. 2019. Vol. 22, N 1. P. 13–19. doi: 10.1097/MCO.0000000000000519
- Batsis J.A., Villareal D.T. Sarcopenic obesity in older adults: etiology, epidemiology and treatment strategies // Nat Rev Endocrinol. 2018. Vol. 14, N 9. P. 513–537. doi: 10.1038/s41574-018-0062-9
- Tomlinson D.J., Erskine R.M., Winwood K., et al. Obesity decreases both whole muscle and fascicle strength in young females but only exacerbates the aging-related whole muscle level asthenia // Physiol Rep. 2014. Vol. 2, N 6. P. e12030. doi: 10.14814/phy2.12030
- Kim K.M., Jang H.C., Lim S. Differences among skeletal muscle mass indices derived from height-, weight-, and body mass index-adjusted models in assessing sarcopenia // Korean J Intern Med. 2016. Vol. 31, N 4. P. 643–650. doi: 10.3904/kjim.2016.015
- Newman A.B., Kupelian V., Visser M., et al. Sarcopenia: alternative definitions and associations with lower extremity function // J Am Geriatr Soc. 2003. Vol. 51, N 11. P. 1602–1609. doi: 10.1046/j.1532-5415.2003.51534.x
- Ha J., Park T., Kim H.K., et al. Development of a fully automatic deep learning system for L3 selection and body composition assessment on computed tomography // Sci Rep. 2021. Vol. 11, N 1. P. 21656. doi: 10.1038/s41598-021-00161-5
- Prado C.M., Lieffers J.R., McCargar L.J., et al. Prevalence and clinical implications of SARCOPENIC obesity in patients with solid tumours of the respiratory and gastrointestinal tracts: a population-based study // Lancet Oncol. 2008. Vol. 9, N 7. P. 629–635. doi: 10.1016/S1470-2045(08)70153-0
- Martin L., Birdsell L., Macdonald N., et al. Cancer cachexia in the age of obesity: skeletal muscle depletion is a powerful prognostic factor, independent of body mass index // J Clin Oncol. 2013. Vol. 31, N 12. P. 1539–1547. doi: 10.1200/JCO.2012.45.2722
- Popuri K., Cobzas D., Esfandiari N., et al. Body composition assessment in axial CT images using FEM-based automatic segmentation of skeletal muscle // IEEE Trans Med Imaging. 2016. Vol. 35, N 2. P. 512–520. doi: 10.1109/TMI.2015.2479252
- Park J., Gil J.R., Shin Y., et al. Reliable and robust method for abdominal muscle mass quantification using CT/MRI: An explorative study in healthy subjects // PLoS One. 2019. Vol. 14, N 9. P. e0222042. doi: 10.1371/journal.pone.0222042
- Fedorov A., Beichel R., Kalpathy-Cramer J., et al. 3D Slicer as an image computing platform for the quantitative imaging network // Magn Reson Imaging. 2012. Vol. 30, N 9. P. 1323–1341. doi: 10.1016/j.mri.2012.05.001
- Burns J.E., Yao J., Chalhoub D., et al. A machine learning algorithm to estimate sarcopenia on abdominal CT // Acad Radiol. 2020. Vol. 27, N 3. P. 311–320. doi: 10.1016/j.acra.2019.03.011
- Blanc-Durand P., Schiratti J.B., Schutte K., et al. Abdominal musculature segmentation and surface prediction from CT using deep learning for sarcopenia assessment // Diagn Interv Imaging. 2020. Vol. 101, N 12. P. 789–794. doi: 10.1016/j.diii.2020.04.011
- Graffy P.M., Liu J., Pickhardt P.J., et al. Deep learning-based muscle segmentation and quantification at abdominal CT: Application to a longitudinal adult screening cohort for sarcopenia assessment // Br J Radiol. 2019. Vol. 92, N 1100. P. 20190327. doi: 10.1259/bjr.20190327
- Ackermans L.L., Volmer L., Wee L., et al. Deep learning automated segmentation for muscle and adipose tissue from abdominal computed tomography in polytrauma patients // Sensors (Basel). 2021. Vol. 21, N 6. P. 2083. doi: 10.3390/s21062083
- Ronneberger O., Fischer P., Brox T. U-Net: convolutional networks for biomedical image segmentation // Lecture Notes Computer Sci. 2015. P. 234–241. doi: 10.1007/978-3-319-24574-4_28
- Shelhamer E., Long J., Darrell T. Fully convolutional networks for semantic segmentation // IEEE Trans Pattern Anal Mach Intell. 2017. Vol. 39, N 4. P. 640–651. doi: 10.1109/TPAMI.2016.2572683
- Islam S., Kanavati F., Arain Z., et al. Fully-automated deep learning slice-based muscle estimation from CT images for sarcopenia assessment // Clin Radiol. 2022. Vol. 77, N 5. P. e363−e371. doi: 10.1016/j.crad.2022.01.036
- Kim D.W., Kim K.W., Ko Y., et al. Assessment of myosteatosis on computed tomography by automatic generation of a muscle quality map using a web-based toolkit: feasibility study // JMIR Med Inform. 2020. Vol. 8, N 10. P. e23049. doi: 10.2196/23049
- Dong X., Dan X., Yawen A., et al. Identifying sarcopenia in advanced non-small cell lung cancer patients using skeletal muscle CT radiomics and machine learning // Thorac Cancer. 2020. Vol. 11, N 9. P. 2650–2659. doi: 10.1111/1759-7714.13598
- Graffy P.M., Liu J., Pickhardt P.J., et al. Deep learning-based muscle segmentation and quantification at abdominal CT: Application to a longitudinal adult screening cohort for sarcopenia assessment // Br J Radiol. 2019. Vol. 92, N 1100. P. 20190327. doi: 10.1259/bjr.20190327
- Петряйкин А.В., Артюкова З.Р., Низовцова Л.А., и др. Анализ эффективности внедрения системы скрининга остеопороза // Менеджер здравоохранения. 2021. № 2. P. 31–39. doi: 10.21045/1811-0185-2021-2-31-39
- Морозов С.П., Владзимирский А.В., Ледихова Н.В., и др. Московский эксперимент по применению компьютерного зрения в лучевой диагностике: вовлеченность врачей-рентгенологов // Врач и информационные технологии. 2020. № 4. С. 14–23. doi: 10.37690/1811-0193-2020-4-14-23
- Сенюкова О.В., Пятковский С.А., Петряйкин А.В., и др. Автоматическая сегментация мышечной и жировой ткани на КТ-изображениях для оценки состава тела человека и диагностики саркопении // Конференция «Информационные технологии для персонализированной медицины» с блоком летней школы для молодых ученых, 4 ноября 2021 г.: сборник тезисов. Москва, 2021. С. 41. doi: 10.14341/cbaipm-2021-41
Дополнительные файлы