Reaction of 4-Hydroxyspiro[pyrrole-2,3′-pyrrole] and 4′-Hydroxyspiro[imidazole-5,2′-pyrrole] Derivatives with Dicyclohexylcarbodiimide
- 作者: Maslivets A.N.1, Lystsova E.A.1, Khramtsova E.E.1
-
隶属关系:
- Perm State University
- 期: 卷 60, 编号 2-3 (2024)
- 页面: 151–161
- 栏目: Articles
- URL: https://bakhtiniada.ru/0514-7492/article/view/274700
- DOI: https://doi.org/10.31857/S0514749224020029
- EDN: https://elibrary.ru/EKIXIW
- ID: 274700
如何引用文章
全文:
详细
The reaction of substituted 4-hydroxyspiro[pyrrole-2,3′-pyrrole] and 4′-hydroxyspiro[imidazole-5,2′-pyrrole] with dicyclohexylcarbodiimide leads to the corresponding derivatives of 4-ureidospiro[pyrrole-2,3′-pyrrole] and 4′-ureidospiro[imidazole-5,2′-pyrrole]. The thermal decomposition of the obtained ureidospirobisheterocycles proceeds nonselectively.
全文:
Соединения с пиррол-2-оновым каркасом обладают широким фармакологическим профилем [1]. Биологически активные пиррол-2-оны могут иметь как природное (леополиевая кислота А [2], клаузенамид [3], фенопиррозин [4], 2-гидроксифенопиррозин [5]) (рис. 1), так и синтетическое происхождение (рис. 2) [1, 6–10]. Среди производных пиррол-2-онов можно выделить 3-гидроксизамещенные 1,5-дигидро-2Н-пиррол-2-оны, которые обладают антипролиферативной [11, 12]) и противоопухолевой [13] активностью, ингибирующими свойствами в отношении DENV-хеликазы [14] и тирозиназы [15], антибактериальной активностью (рис. 2) [16].
Рис. 1. Производные пиррол-2-она природного происхождения
Рис. 2. Некоторые 3-гидроксизамещенные 1,5-дигидро-2Н-пиррол-2-онов, проявляющие биологическую активность
Стоит отметить, что замена 3-ОН-группы в 3-гидрокси-1,5-дигидро-2Н-пиррол-2-онах на 3-NHR-заместитель может сильно влиять на биологическую активность 1,5-дигидро-2Н-пиррол-2-онов. Например, некоторые 3-амино-1,5-дигидро-2Н-пиррол-2-оны имеют бо́льшую ингибирующую активность в отношении раковых клеток в сравнении с соответствующими 3-гидрокси-1,5-дигидро-2Н-пиррол-2-онами (рис. 3) [12].
Рис. 3. Антипролиферативная активность некоторых 3-гидрокси- и 3-амино-1,5-дигидро-2Н-пиррол-2-онов [12]
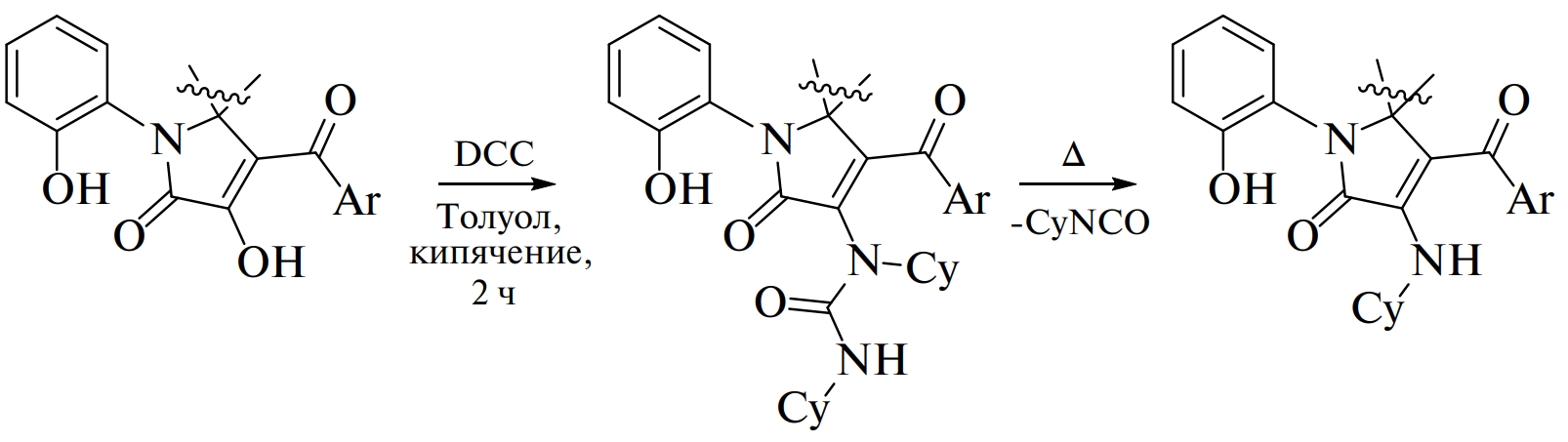
Ранее нами был разработан подход к получению аминированных спиро[имидазол-5,2′-пирролов] 5 (схема 1) [17], эффективный в тех случаях, когда аминирование 3-гидрокси-1,5-дигидро-2Н-пиррол-2-онов 1 классическим методом (их реакцией с аминами 6) невозможно (схема 1). Данный подход [17] включает 2 этапа. Первый этап заключается в замещении OH-группы в положении С3 пиррольного фрагмента соединений 1 на уреидную группу реакцией с карбодиимидами 2, в результате чего образуются уреиды 3. Второй этап — термолиз уреидов 3 с образованием изоцианатов 4 и целевых 3-аминозамещенных пиррол-2-онов 5.
Целью настоящей работы является исследование применимости предложенного нами ранее подхода [17] (схема 1) к синтезу новых аминированных спиро[пиррол-2,3′-пирролов] и спиро[имидазол-5,2′-пирролов].
Взаимодействие соединения 7a с дициклогексилкарбодиимидом 8 приводит к образованию уреидоспироцикла 9a (схема 2). Стоит отметить, что согласно данным ЯМР исходное соединение 7а существует в мостиковой форме А [18]. По-видимому, форма А находится в равновесии со спиробисциклической формой В [18], которая и вступает в реакцию с карбодиимидом 8 с образованием соединения 9а.
Структура соединения 9а подтверждена методом РСА (рис. 4).
Рис. 4. Общий вид молекулы соединения 9а по данным РСА в тепловых эллипсоидах 30%-ной вероятности
Соединение 9а кристаллизуется в центросимметричной пространственной группе моноклинной сингонии. Взаимное расположение бензоильного заместителя и фрагмента мочевины определяется наличием внутримолекулярной водородной связи N4–H4∙∙∙O6. За счет межмолекулярных водородных связей O5–H5∙∙∙O4 [0.5–x, 0.5+y, 0.5–z] в кристалле молекулы связаны в бесконечные цепи.
Взаимодействие соединения 7b с дициклогексилкарбодиимидом 8 приводит к образованию уреидоспироцикла 9b (схема 3). Примечательно, что исходное соединение 7b существует в форме иминиевой соли D [19], находящейся, по-видимому, в равновесии с 3-гидроксипиррол-2-оновой формой E, которая и вступает в реакцию с карбодиимидом 2 с образованием соединения 9b.
Соединения 9a,b получают в результате нуклеофильной атаки енольной группы имидного атома углерода карбодиимида 8, приводящей к образованию изомочевин C, F, в которых происходит нуклеофильная атака вторичной группой NH атома С3 пиррол-2-онового фрагмента с образованием C3–N связи и одновременный разрыв связи C3–O. Аналогичная последовательность стадий наблюдается при образовании побочных продуктов при этерификации по Штеглиху [20]. Протекание реакции по енольной группе объясняется тем, что фенольная гидроксигруппа имеет более низкую кислотность, а значит, менее реакционноспособна во взаимодействиях с карбодиимидами [21].
Установление структуры полученных продуктов проводили методами ИК и ЯМР спектроскопии (рис. 4–6). Структура продукта 9а установлена данными РСА, и на основании сравнения его спектров ИК, ЯМР 1Н и 13С со спектрами модельных соединений 3, 5 [17] и исходного соединения 7а (рис. 4). Структура соединения 9b установлена на основании сравнения его спектров ИК, ЯМР 1Н со спектрами модельных соединений 3, 5 [17] и исходного соединения 7b (рис. 4) [19].
Рис. 4. Характеристические сигналы соединений 7а,b, 9а,b и 3, 5 [17] по данным ИК спектров
Так, в ИК спектрах продуктов 9а и 9b и соединения 5 наблюдаются характеристические сигналы карбонильной группы фрагмента мочевины в области 1630–1645 см-1. Данные сигналы отсутствуют в ИК-спектрах исходных соединений 9а,b и 3.
В спектрах ЯМР 1Н продуктов 9а и 9b и соединения 5 присутствуют дублеты NH-группы уреидного фрагмента в области 5.37–6.86 м.д., отсутствующие в спектрах исходных соединений 7а,b и 3. Также в спектрах ЯМР 1Н продуктов 9а,b наблюдаются сигналы протонов 2 циклогексильных фрагментов в области 0.84–3.74 м.д.
В спектрах ЯМР 13С продукта 9а и аналога 5 наблюдается сигнал в слабопольной области при 142.1–148.5 м.д., соответствующий карбонильному атому углерода во фрагменте мочевины, и сигнал в области 138.4–139.1 м.д., соответствующий атому углерода С4. Атом С4 енольной группы располагается в более слабопольной области при 169.2 м.д. (на примере соединения 3), а атом углерода фенольного фрагмента при ОН-группе в соединениях 9а, 7а,b и 3, 5 наблюдается в диапазоне 154.2–154.7 м.д. Также в спектрах ЯМР 13С продукта 9а присутствуют сигналы атомов углерода 2 циклогексильных фрагментов в области 24.9–57.3 м.д.
Рис. 5. Характеристические сигналы соединений 7а,b, 9а,b и 3, 5 [17] по данным ЯМР ¹Н спектров
Таким образом, на основании данных ИК и ЯМР спектров продуктов 9а и 9b можно утверждать о наличии уреидного фрагмента при атоме углерода C4 пиррольного цикла.
Попытки синтеза соединений 10a,b термическим разложением соединений 9a,b (в диапазоне температур 255–259°С для соединения 9a и 260–264°С для соединения 9b) не оказались успешными. В результате термолиза соединений 9a,b образовывалось множество неидентифицируемых продуктов, а соединения 10a,b определялись в следовых количествах (по данным ультра-ВЭЖХ-УФ-МС реакционных смесей). Так, в спектре реакционных масс с ожидаемым продуктом 10а присутствовал пик соединения с сигналами ионов с молекулярной массой 713 [M + H]+ (ESI+, расчетная масса C42H37N3O8+H+ 713 [M + H]+) и 711 [M — H]- (ESI–, расчетная масса C42H37N3O8–H- 711 [M — H]-), а с ожидаемым продуктом 10b — пик соединения с сигналами ионов с молекулярной массой 647 [M + H]+ (ESI+, расчетная масса C37H32ClN5O4 +H+ 647 [M + H]+), 645 [M — H]- (ESI–, расчетная масса C37H32ClN5O4–H+ 645 [M — H]-). Варьирование условий реакции (изменение продолжительности нагрева от 15 мин до 9 ч и температур от 235 до 300°С) не привело к увеличению выходов целевых соединений 10a,b.
н.д. — нет данных ЯМР спектра из-за низкой растворимости соединения в ДМСО-d6 и CDCl3
Рис. 6. Характеристические сигналы соединений 7а,b, 9а,b и 3, 5 [17] по данным ЯМР ¹³C спектров
Такие результаты могут объясняться тем, что соединения 9a,b в своей структуре содержат спирогетероциклические надстройки — замещенные пиррольный (продукт 9a) и имидазольный (продукт 9b) циклы, которые, по-видимому, подвергаются разложению при исследованных температурах.
Метил 9-бензоил-1-(2-гидроксифенил)-7-(4-метоксифенил)-2,3,8-триоксо-4-фенил-2,3,7,8-тетрагидро-1Н,6Н-6,8а-метанопирроло[2,3-e][1,3]оксазепин-6-карбоксилат (7a). Смесь 500 мг (0.157 ммоль) 3-бензоилпирроло[2,1-c][1, 4]бензоксазин-1,2,4-триона и 460 мг (0.157 ммоль) метил-4-(4-метоксифенил)-4-оксо-2-(фениламино)-бут-2-еноата кипятили в 20 мл безводного бензола с обратным холодильником в течение 1 ч. Охлаждали. Выпавший осадок отфильтровывали, перекристаллизовали из этилацетата. Выход 820 мг (85%), т.пл. 236–238°C (разл.), кристаллическое вещество светло-желтого цвета. ИК спектр, ν, см-1: 3287 ш, 3187 ш, 1764, 1724, 1714, 1685. Спектр ЯМР 1Н (400 МГц, ДМСО-d6), δ, м.д.: 3.27 с (3H, COOMe), 3.71 с (3H, C6H4OMe), 5.20 с (1H, С9H), 6.94 м (4Hаром), 7.06 м (2Hаром), 7.32 м (1Hаром), 7.44 м (1Hаром), 7.54 м (2Hаром), 7.62–7.72 м (4Hаром), 7.78 м (2Hаром), 7.98 м (2Hаром), 9.92 c (1H, ОH). Спектр ЯМР 13С (100 МГц, ДМСО-d6), δ, м.д.: 53.4, 55.2, 65.1, 92.3, 106.1, 114.7, 116.7, 119.3, 120.5, 126.3, 126.5 (3C), 128.0 (3C), 128.4 (3C), 128.8 (3C), 129.4, 130.5, 131.0, 133.1, 133.8, 136.4, 153.9, 158.9, 160.9, 162.0, 162.1, 168.2, 176.8, 190.3. Масс-спектр, m/z: 632 [М]+. Найдено, %: C 68.91; H 4.23; N 4.54. C36H26N2O9. Вычислено, %: C 68.57; H 4.16; N 4.44.
Метил 4,9-дибензоил-1-(2-гидроксифенил)-7-(4-метоксифенил)-2,6-диоксо-3-(1,3-дициклогексилуреидо)-1,7-диазоспиро[4.4]нона-3,8-диен-8-карбоксилат (9a). Смесь 100 мг (0.159 ммоль) соединения 1а и 36 мг (0.175 ммоль) дициклогексилкарбодиимида 2 кипятили в 2 мл толуола с обратным холодильником в течение 2 ч. Охлаждали. Выпавший осадок отфильтровывали, промывали этанолом. Выход 104 мг (78%), т.пл. 256–258°C (разл.), кристаллическое вещество белого цвета. ИК спектр, ν, см-1: 3388, 3141, 3083, 1777, 1756, 1718, 1656, 1630. Спектр ЯМР 1Н (400 МГц, ДМСО-d6), δ, м.д.: 0.98–0.84 м (1H, Cy), 1.18–1.07 м (3H, Cy), 1.35–1.26 м (3H, Cy), 1.77–1.45 м (8H, Cy), 1.94 м (1H, Cy), 2.81 с (3H, Cy), 3.26 с (4H, Cy+COOMe), 3.48 м (1H, Cy), 3.74 м (1H, Cy), 3.81 с (3H, C6H4OMe), 5.37 д (1H, NH, J 7.2 Гц), 6.89 м (1Hаром), 6.96 м (1Hаром), 7.01 м (2Hаром), 7.08 м (3Hаром), 7.30 м (5Hаром), 7.53 м (3Hаром), 7.72 м (1Hаром), 8.06 м (2Hаром), 9.92 c (1H, ОH). Спектр ЯМР 13С (100 МГц, ДМСО-d6), δ, м.д.: 24.9, 25.0, 25.4, 25.7, 26.0, 30.8, 31.8, 33.0, 33.5, 33.8, 50.0, 53.0, 56.0, 57.3, 73.7, 115.0, 115.2 (2С), 115.6, 117.0, 119.7, 122.5, 126.7, 128.0 (2C), 128.5 (2С), 128.8 (2C), 128.9, 128.9 (2С), 129.8 (2C), 130.5, 133.2, 134.5, 136.0, 138.3, 138.4, 148.5, 154.4, 154.7, 159.4, 160.1, 167.1, 172.5, 188.9, 190.9. Масс-спектр, m/z: 838 [М]+. Найдено, %: C 70.43; H 5.81; N 6.64. C49H48N4O9. Вычислено, %: C 70.32; H 5.78; N 6.69.
1-(6-(2-Гидроксифенил)-2-имино-4,7-диоксо-1,3-дифенил-9-(4-хлорбензоил)-1,3,6-триазаспиро[4.4]нон-8-ен-8-ил)-1,3-дициклогексилмочевина (9b). Смесь 100 мг (0,177 ммоль) соединения 1b и 73 мг (0.354 ммоль) дициклогексилкарбодиимида 2 кипятили в 2 мл толуола с обратным холодильником в течение 2 ч. Охлаждали. Выпавший осадок отфильтровывали, промывали этанолом. Выход 104 мг (76%), т.пл. 261–263°C (разл.), бесцветное кристаллическое вещество. ИК спектр, ν, см-1: 3241, 3186, 3116, 3055, 1786, 1694, 1664, 1633. Спектр ЯМР 1Н (400 МГц, ДМСО-d6), δ, м.д.: 1.0–0.86 м (9H, Cy), 1.47–1.24 м (11H, Cy), 2.79 м (1H, Cy), 3.16 м (1H, Cy), 6.86 д (1H, NH, J 6.4 Гц), 6.96 м (1Hаром), 7.40–7.18 м (11Hаром), 7.05 м (1Hаром), 7.56 м (3Hаром), 7.70 м (2Hаром), 7.88 уш. с (1H, NHиминогр.), 9.79 уш.с (1H, ОH). Масс-спектр, m/z: 772 [М]+. Найдено, %: C 68.29; H 5.60; N 10.93. C44H43ClN6O5. Вычислено, %: C 68.52; H 5.62; N 10.90.
Рентгеноструктурный анализ выполнен на монокристальном дифрактометре Xcalibur Ruby с CCD-детектором (MoKα-излучение, 295(2) K, ω-сканирование с шагом 1°). Поглощение учтено эмпирически с использованием алгоритма SCALE3 ABSPACK [22]. Структура расшифрована с помощью программы SHELXS [23] и уточнена полноматричным методом наименьших квадратов по F2 в анизотропном приближении для всех неводородных атомов с использованием программы SHELXL [24] с графическим интерфейсом OLEX2 [25]. Атомы водорода групп NH и OH уточнены независимо. При уточнении остальных атомов водорода использована модель наездника. Сингония кристалла (C49H48N4O9) моноклинная, пространственная группа P21/n, a 11.323(2) Å, b 21.216(3) Å, c 18.407(5) Å, β 95.70(2)°, V 4400.3(17) Å3, Z 4, dвыч 1.263 г/см3, μ 0.088 мм–1. Окончательные параметры уточнения: R1 0.0808 [для 3732 отражений с I > 2σ(I)], wR2 0.2380 (для всех 10442 независимых отражений, Rint 0.0927), S 0.968. Результаты РСА зарегистрированы в Кембриджской базе структурных данных под номером CCDC 2281173 и могут быть запрошены по адресу: www.cCDc.cam.ac.uk/structures.
ИК-спектры полученных соединений записаны на спектрофотометре Spectrum Two (Perkin Elmer, США) в виде пасты в вазелиновом масле. Спектры ЯМР 1Н и 13С записаны на спектрометре Bruker AVANCE III HD 400 (Швейцария) [рабочая частота 400 (1Н) и 100 (13С) МГц] в ДМСО-d6, внутренний стандарт — остаточные сигналы растворителя (2.50 м.д. для ядер 1H, 39.5 м.д. для ядер 13С). Элементный анализ выполнен на анализаторе vario Micro cube (Германия). Температуру плавления определяли на аппарате Mettler Toledo MP70 (Швейцария). Оптимизация условий реакции, анализ реакционных масс проводили методом ультра-ВЭЖХ-УФ-МС на приборе Waters ACQUITY UPLC I-Class (колонка Acquity UPLC BEH C18 1.7 мкм, подвижная фаза — ацетонитрил–вода, скорость потока 0.6 мл/мин, диодно-матричный детектор ACQUITY UPLC PDA eλ Detector (диапазон длин волн 230–780 нм) (Thermo Fisher Scientific, США), масс-спектрометрический детектор Xevo TQD (Agilent, США), ионизация электрораспылением (ESI), обнаружение положительных и отрицательных ионов, температура источника 150°С, напряжение на капилляре 3500–4000 В, напряжение на конусе 20–70 В, температура испарения 200°С). Исходное соединение 7a получено аналогично ранее описанной методике [18], 3-бензоилпирроло[2,1-c][1, 4]бензоксазин-1,2,4-трион получен по методике [26], метил 4-(4-метоксифенил)-4-оксо-2-(фениламино)бут-2-еноат по методике [27], исходное соединение 7b синтезировано в соответствии с методикой [19]. Карбодиимид 8 получен у коммерческого поставщика Sigma Aldrich. Толуол перегоняли над натрием перед использованием, остальные растворители и реагенты получены у коммерческого поставщика (ВЕКТОН) и использовались без дополнительной очистки.
ЗАКЛЮЧЕНИЕ
В ходе исследования синтезированы метил1-(2-гидроксифенил)-4,9-дибензоил-7-(4-метоксифенил)-2,6-диоксо-3-(1,3-дициклогексилуреидо)-1,7-диазоспиро[4.4]нона-3,8-диен-8-карбоксилат (9а) и 1-(6-(2-гидроксифенил)-2-имино-4,7-диоксо-1,3-дифенил-9-(4-хлорбензоил)-1,3,6-триазаспиро[4.4]нон-8-ен-8-ил)-1,3-дициклогексилмочевина (9b), труднодоступные для получения иными методами.
Установлено, что подход, предложенный ранее [17], имеет ограничения для синтеза некоторых 5-спирозамещенных 3-амино-1,5-дигидро-2Н-пиррол-2-онов, а реакции термолиза протекают неселективно в случае использования исходных продуктов типа метил 1-(2-гидроксифенил)-4,9-дибензоил-7-(4-метоксифенил)-2,6-диоксо-3-(1,3-дициклогексилуреидо)-1,7-диазоспиро[4.4]нона-3,8-диен-8-карбоксилата (9а) и 1-(6-(2-гидроксифенил)-2-имино-4,7-диоксо-1,3-дифенил-9-(4-хлорбензоил)-1,3,6-триазаспиро[4.4]нон-8-ен-8-ил)-1,3-дициклогексилмочевины (9b), в структуре которых есть замещенные пиррольный (продукт 9a) и имидазольный (продукт 9b) циклы, по-видимому, термически неустойчивые в исследованных условиях.
БЛАГОДАРНОСТИ
Авторы выражают благодарность Дмитриеву Максиму Викторовичу (ПГНИУ, Пермь, Россия) за выполнение исследований методом рентгеноструктурного анализа.
ФОНДОВАЯ ПОДДЕРЖКА
Исследования выполнены при финансовой поддержке Пермского научно-образовательного центра “Рациональное недропользование”.
КОНФЛИКТ ИНТЕРЕСОВ
Авторы заявляют об отсутствии конфликта интересов.
作者简介
A. Maslivets
Perm State University
Email: koh2@psu.ru
ORCID iD: 0000-0001-7148-4450
俄罗斯联邦, ul. Bukireva, 15, Perm, 614990
E. Lystsova
Perm State University
Email: koh2@psu.ru
ORCID iD: 0000-0003-0453-0589
俄罗斯联邦, ul. Bukireva, 15, Perm, 614990
E. Khramtsova
Perm State University
编辑信件的主要联系方式.
Email: koh2@psu.ru
ORCID iD: 0000-0002-5851-3082
俄罗斯联邦, ul. Bukireva, 15, Perm, 614990
参考
- Asif M., Alghamdi S. Russ. J. Org. Chem. 2021, 57, 1700–1718. doi: 10.1134/S1070428021100201
- Raju R., Gromyko O., Fedorenko V., Luzhetskyy A., Muller R. Tetrahedron Lett. 2012, 53, 6300–6301. doi: 10.1016/j.tetlet.2012.09.046
- Hartwig W., Born L. J. Org. Chem. 1987, 52, 4352–4358. doi: 10.1021/jo00228a037
- Shiomi K., Yang H., Xu Q., Arai N., Namiki M., Hayashi M., Inokoshi J., Takeshima H., Masuma R., Komiyama K., Omura S. J. Antibiot. 1995, 48, 1413–1418. doi: 10.7164/antibiotics.48.1413
- Park Y.C., Gunasekera S.P., Lopez J.V., McCarthy P.J., Wright A.E. J. Nat. Prod. 2006, 69, 580–584. doi: 10.1021/np058113p
- Han Y., Wu Q., Sun J., Yan C.-G. Tetrahedron. 2012, 68, 8539–8544. doi: 10.1016/j.tet.2012.08.030
- Xiang B., Belyk K.M., Reamer R.A., Yasuda N. Angew. Chem. Int. Ed. 2014, 53, 8357–8378. doi: 10.1002/anie.201404084
- Song R.-J., Li J.-H., Qian P.-C., Liu Y., Xiang J.-N. Synlett. 2015, 26, 1213–1216. doi: 10.1055/s-0034-1380573
- Geesi M.H., Ouerghi O., Dehbi O., Riadi Y. J. Environ. Chem. Eng. 2021, 9, 105344. doi: 10.1016/j.jece.2021.105344
- Matiadis D., Stefanou V., Tsironis D., Panagiotopoulou A., Igglessi-Markopoulou O., Markopoulos J. Arch. Pharm. 2021, 354, e2100305. doi: 10.1002/ardp.202100305
- Olla S., Manetti F., Crespan E., Maga G., Angelucci A., Schenone S., Bologna M., Botta M. Bioorg. Med. Chem. Lett. 2009, 19, 1512–1516. doi: 10.1016/j.bmcl.2009.01.005
- del Corte X., Lopez-Frances A., Villate-Beitia I., Sainz-Ramos M., Palacios F., Alonso C., de los Santos J.M., Pedraz J.L., Vicario J. Pharmaceuticals (Basel.). 2022, 15, 511–530. doi: 10.3390/ph15050511
- Козьминых В.О., Игидов Н.М., Зыкова С.С., Колла В.Е., Щуклина Н.С., Одегова Т.Ф. ХФЖ. 2002, 36, 23–26. [Koz’minykh V.O., Igidov N.M., Zykova S.S., Kolla V.E., Shuklina N.S., Odegova T.F. Pharm. Chem. J. 2002, 36, 188–191.] doi: 10.1023/A:1019832621371
- Sweeney N.L., Hanson A.M., Mukherjee S., Ndjomou J., Geiss B.J., Steel J.J., Frankowski K.J., Li K., Schoenen F.J., Frick D.N. ACS Infect. Dis. 2015, 1, 140–148. doi: 10.1021/id5000458
- Alizadeh N., Sayahi M.H., Iraji A., Yazzaf R., Moazzam A., Mobaraki K., Adib M., Attarroshan M., Larijani B., Rastegar H., Khoshneviszadeh M., Mahdavi M. Bioorg. Chem. 2022, 126, 105876. doi: 10.1016/j.bioorg.2022.105876
- Valdes-Pena M.A., Massaro N.P., Lin Y.-C., Pierce J.G. Acc. Chem. Res. 2021, 54, 1866–1877. doi: 10.1021/acs.accounts.1c00007
- Khramtsova E.E., Lystsova E.A., Khokhlova E.V., Dmitriev M.V., Maslivets A.N. Molecules. 2021, 26, 7179. doi: 10.3390/molecules26237179
- Рачева Н.Л., Алиев З.Г., Масливец А.Н. ЖОрХ. 2008, 44, 1197–1201. [Racheva N.L., Aliev Z.G., Maslivets A.N. Russ. J. Org. Chem. 2008, 44, 1184–1189.] doi: 10.1134/S1070428008080137
- Кобелев А.И., Дмитриев М.В., Масливец А.Н. ЖОрХ. 2021, 57, 103–108. [Kobelev A.I., Dmitriev M.V., Maslivets A.N. Russ. J. Org. Chem. 2021, 57, 108–112.] doi: 10.1134/S1070428021010152
- Lutjen A.B., Quirk M.A., Barbera A.M., Kolonko E.M. Bioorg. Med. Chem. 2018, 26, 5291–5298. doi: 10.1016/j.bmc.2018.04.007
- Williams A., Ibrahim I.T. Chem. Rev. 1981, 81, 589–636. doi: 10.1021/cr00046a004
- CrysAlisPro, Agilent Technologies, Version 1.171.37.33.
- Sheldrick G.M. Acta Crystallogr., Sect. A: Found. Crystallogr. 2008, 64, 112–122. doi: 10.1107/S0108767307043930
- Sheldrick G.M. Acta Crystallogr., Sect. C: Struct. Chem. 2015, 71, 3–8. doi: 10.1107/S2053229614024218
- Dolomanov O.V., Bourhis L.J., Gildea R.J, Ho-ward J.A.K., Puschmann H. J. Appl. Cryst. 2009, 42, 339–341. doi: 10.1107/S0021889808042726
- Масливец А.Н., Машевская И.В., Красных О.П., Шуров С.Н., Андрейчиков Ю.С. ЖОрХ. 1992, 28, 2545–2553. [Maslivets A.N., Mashevskaya I.V., Krasnykh O.P., Shurov S.N., Andreichikov Yu.S. J. Org. Chem. USSR. 1992, 28, 2056–2062.]
- Андрейчиков Ю.С., Масливец А.Н., Смирнова Л.И., Красных О.П., Козлов А.П., Перевозчиков Л.А. ЖОрХ. 1987, 23, 1534. [Andreichikov Yu.S., Maslivets A.N., Smirnova L.I., Krasnykh O.P., Kozlov A.P., Perevozchikov L.A. J. Org. Chem. USSR. 1987, 23, 1378–1387.]
补充文件