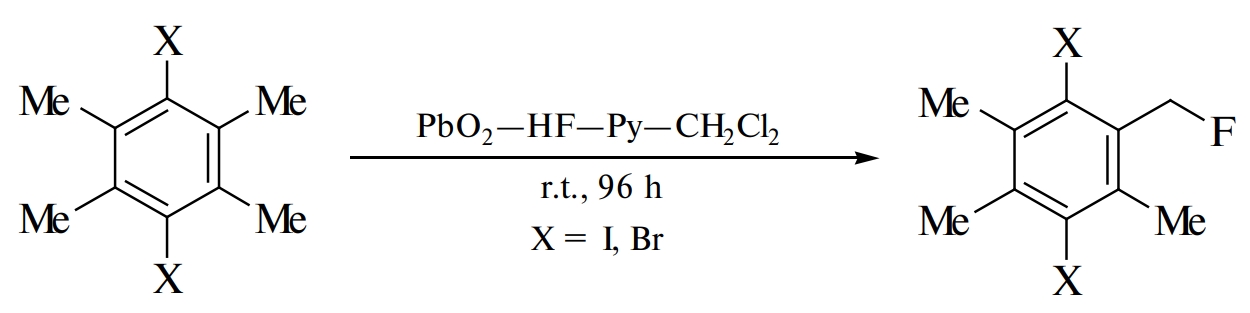Oxidative Monofluorination of 1,4-Diiodo(or Dibromo)-2,3,5,6-tetramethylbenzenes in the System PbO₂—HF—Py—CH₂Cl₂
- Authors: Kalyaev M.V.1,2, Ryabukhin D.S.1,3, Vasilyev A.V.1,2
-
Affiliations:
- Saint Petersburg State Forest Technical University
- Saint Petersburg State University
- All-Russia Research Institute for Food Additives, V.M. Gorbatov Federal Research Center for Food Systems of RAS
- Issue: Vol 60, No 2-3 (2024)
- Pages: 146–150
- Section: Articles
- URL: https://bakhtiniada.ru/0514-7492/article/view/274699
- DOI: https://doi.org/10.31857/S0514749224020011
- EDN: https://elibrary.ru/EKKJSS
- ID: 274699
Cite item
Full Text
Abstract
The oxidation of 1,4-diiodo-2,3,5,6-tetramethylbenzene (diiododurene) and 1,4-dibromo-2,3,5,6-tetramethylbenzene (dibromodurene) by lead dioxide PbO₂ in Olah reagent, hydrogen fluoride-pyridine mixture, with CH₂Cl₂ as a co-solvent at room temperature for 96 h results in the corresponding products of monofluorination of methyl group. This is the first example of using the oxidative system PbO₂—HF—Py—CH₂Cl₂ for side-chain monofluorination of methylated benzenes.
Full Text
ВВЕДЕНИЕ
Фторорганические соединения имеют большое значение для химии, биологии, медицины, сельского хозяйства и материаловедения [1–13]. Разработка новых методов синтеза фторированных соединений является актуальной задачей органической химии. Одно из важных направлений в этой области — монофторирование, т.е. селективное введение только одного атома фтора в определенное положение органической молекулы [14]. Электрохимическое окисление в безводном фтористом водороде HF позволяет получать фторированные органические [15–17] и неорганические соединения [18, 19]. В конце 1970-х гг. исследовано окислительное фторирование аренов, содержащих сильные электроноакцепторные заместители (NO2, CN, COMe и др.), диоксидом свинца PbO₂ (и другими оксидами и солями различных металлов) в жидком HF [20, 21]. Было обнаружено, что фторирование происходит по метильным группам боковой цепи и/или по ароматическому кольцу. Ранее мы также использовали систему PbO₂–HF для окисления электронодефицитных диарилацетиленов, что приводило к получению димерных фторированных продуктов окисления [22]. Однако фтористый водород — опасное вещество! Он имеет низкую температуру кипения 19.5°C, очень летуч. Работа с жидким HF требует специальных мер предосторожности. Более безопасная фторирующая система, представляющая собой смесь фтористого водорода (70%) и пиридина Py (30%), называется “реагентом Ола” и является коммерчески доступной. Мягкие фторирующие свойства этой системы были открыты лауреатом Нобелевской премии 1994 г. Дж. Ола [23]. В настоящее время система HF–Py широко используется в органическом синтезе [24–28]. Основываясь на наших исследованиях по окислению алкинов с помощью PbO₂ в кислотах Бренстеда [29], а также по функционализации боковой цепи иод- и бромзамещенных полиметилзамещенных аренов в системе PbO₂–CF3CO2H–CH₂Cl₂ [30], мы изучили монофторирование боковой цепи таких галогенаренов, которые являются важными субстратами для реакций кросс-сочетания, катализируемых переходными металлами [31–33]. Основной целью данной работы являлось исследование окислительного монофторирования иод- и бромзамещенных полиметиларенов в системе PbO₂–HF–Py–CH₂Cl₂.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Сначала было осуществлено окисление 1,4-дииод-2,3,5,6-тетраметилбензола (дииоддурола) 1a в системе PbO₂–HF при 0°C. Однако в этих условиях электронодонорный арен 1a очень легко окисляется с образованием олигомерных веществ (таблица, опыт 1). Использование системы PbO₂–HF–Py и CH₂Cl₂ в качестве сорастворителя дало продукт монофторирования метильной группы боковой цепи 2a. Проведение реакции при низкой температуре 0°C в течение 3 ч (таблица, опыт 2) или при комнатной температуре в течение 14 ч (таблица, опыт 3) позволило получить небольшое количество целевого соединения 2a при неполной конверсии исходного арена. Пролонгирование реакции до 96 ч при комнатной температуре привело к увеличению выхода продукта монофторирования 2а до 24% (таблица, опыты 4, 5), сопровождающегося образованием олигомерных веществ.
Окисление дибромдурола 1b в этих же условиях дало соединение 2b с выходом 26%, наряду с олигомерными веществами (схема 1).
Таблица. Окисление дииоддурола 1a в системах PbO₂–HF или PbO₂–HF–Py–CH₂Cl₂, приводящее к образованию монофторированногосоединения 2a
Опыт | Условия реакции | Выход соединения 2a, % | ||
окислительная система | температура, °C | время, ч | ||
1 | PbO₂–HF | 0 | 2 | –а |
2 | PbO₂–HF–Py–CH₂Cl₂ | 0 | 3 | < 5b |
3 | PbO₂–HF–Py–CH₂Cl₂ | 20 | 14 | < 5b |
4 | PbO₂–HF–Py–CH₂Cl₂ | 20 | 48 | 17а |
5 | PbO₂–HF–Py–CH₂Cl₂ | 20 | 96 | 24а |
a Образование олигомерных веществ
b Неполная конверсия исходного вещества 1a
Схема 1
Также было проведено окисление 1-иод-2,4,6-триметилбензола (иодмезитилена) и 1-бром-2,4,6-триметилбензола (броммезитилена), но в результате получены только сложные смеси олигомерных продуктов реакций.
Предполагаемый механизм реакции представлен на схеме 2. Диоксид свинца в кислых средах действует как одноэлектронный окислитель [29, 34]. Таким образом, первым этапом в этом превращении является образование катион-радикалов Aa,b из исходных соединений 1a,b. Депротонирование частиц Aa,b приводит к образованию радикалов Ba,b, последующее одноэлектронное окисление которых дает катионы бензильного типа Ca,b. Взаимодействие этих катионов с фторид-ионом приводит к монофторированным веществам 2а,b. Интермедиаты Ca,b могут принимать участие в других катионных превращениях, таких как реакция Фриделя–Крафтса, взаимодействие с нуклеофилами и т.д., что приводит к образованию олигомерных веществ.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Спектры ЯМР 1H, 13C и 19F регистрировали на спектрометре Bruker AM-400 (рабочие частоты 400, 100 и 375 МГц соответственно) в CDCl3. В качестве внутренних стандартов использовали остаточные сигналы CHCl3 (dН 7.26 м.д.) в спектрах ЯМР 1Н, сигнал растворителя CDCl3 (dС 77.0 м.д.) – в спектрах ЯМР 13С. Спектры ЯМР 19F отнесены к сигналу CFCl3 (δF 0.0 м.д.). Масс-спектры высокого разрешения записывали на приборах Bruker maXis RMS-ESI-QTOF с ионизацией электроспреем. Хромато-масс-спектральный анализ смесей соединений выполняли на приборе Shimadzu GCMS QP-2010 SE. Контроль за ходом реакции осуществляли методом ТСХ на пластинах ALUGRAM SIL G/UV254. Для разделения реакционных смесей использовали силикагель Merck 60 и гексан в качестве элюента.
Схема 2
Соединения 2a,b. Общая методика. Окисление соединений 1a,b в системе PbO₂–HF–Py–CH₂Cl₂. К раствору арена 1a,b (0.13 ммоль; 1 a — 50 мг, 1b — 38 мг) в HF–Py (Sigma-Aldrich) (1.5 мл) и CH₂Cl₂ (1 мл) при интенсивном перемешивании прибавляли PbO₂ (62 мг, 0.26 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 96 ч и вливали в воду (50 мл). Затем к водной смеси добавляли твердый NaHCO3 до достижения рН 7.0–8.0. Продукты реакции экстрагировали хлороформом (3 × 30 мл). Объединенные экстракты промывали водой (50 мл), сушили Na2SO4. Растворитель удаляли при пониженном давлении, остаток подвергали колоночной хроматографии на силикагеле с использованием гексана в качестве элюента.
Аналогично проводили окисление соединений 1a,b в системе PbO₂–HF (5 мл) при 0°C в течение 3 ч (таблица, опыт 1).
1,4-Дииод-2,3,5-триметил-6-(фторметил)бензол (2a). Выход 13 мг (24%). Бесцветное твердое вещество, т.пл. 92–94°C. Спектр ЯМР 1H (400 MГц, CDCl3), δ, м.д.: 2.65 с (3H, Me), 2.67 д (3H, Me, J 3.0 Гц), 2.72 д (3H, Me, J 2.1 Гц), 5.82 д (2H, CH2, J 47.9 Гц). Спектр ЯМР 13C (100 MГц, CDCl3), δ, м.д.: 28.6, 29.7, 30.2д (JC-F 1.4 Гц), 90.0 д (JC-F 166.2 Гц), 112.1 д (JC-F 4.7 Гц), 112.9 д (JC-F 4.2 Гц), 134.9 д (JC-F 14.8 Гц), 138.8 д (JC-F 3.0 Гц), 141.1 д (JC-F 3.0 Гц), 142.5 д (JC-F 4.4 Гц). Спектр ЯМР 19F (375 MГц, CDCl3), δ, м.д.: –205.73. Масс-спектр (ГХ-МС), m/z (Iотн., %): 404 (100) [M]+, 384 (5), 277 (36), 249 (4), 202 (4), 192 (4). HRMS, m/z: найдено C10H12FI2 [M + H]: 404.9007; вычислено 404.9010.
1,4-Дибром-2,3,5-триметил-6-(фторметил)бензол (2b). Выход 10 мг (26%). Бесцветное твердое вещество, т.пл. 82–84°C. Спектр ЯМР 1H (400 MГц, CDCl3), δ, м.д.: 2.51 с (3H, Me), 2.53 д (3H, Me, J 3.0 Гц), 2.59 д (3H, Me, J 2.0 Гц), 5.74 д (2H, CH2, J 47.8 Гц). Спектр ЯМР 13C (100 MГц, CDCl3), δ, м.д.: 21.5, 22.3, 22.7 д (JC-F 1.3 Гц), 83.5 д (JC-F 164.9 Гц), 128.7 д (JC-F 4.5 Гц), 129.02 д (JC-F 3.8 Гц), 132.3 д (JC-F 14.9 Гц), 136.0 д (JC-F 3.0 Гц), 138.1 д (JC-F 3.1 Гц), 139.8 д (JC-F 4.4 Гц). Спектр ЯМР 19F (375 MГц, CDCl3), δ, м.д.: –207.58. Масс-спектр (ГХ-МС), m/z (Iотн., %): 308 (40) [M]+, 306 (35), 290 (100), 275 (4), 227 (4), 209 (38). HRMS, m/z: найдено C10H12FBr2 [M + H]: 308.9284; вычислено 308.9288.
ЗАКЛЮЧЕНИЕ
Впервые окислительная система PbO₂–HF–Py с сорастворителем CH₂Cl₂ использована для монофторирования метильной группы в боковой цепи дииод- и дибромдуролов. Полученные фторметилзамещенные иод- и бромарены являются важными субстратами для реакций кросс-сочетания.
БЛАГОДАРНОСТИ
Спектральные исследования были проведены в ресурсных центрах “Методы анализа состава вещества” СПбГУ, а также “Магнитно-резонансные методы исследования” в соответствии с государственным заданием Российской Федерации № АААА-А19-119091190094.
КОНФЛИКТ ИНТЕРЕСОВ
Авторы заявляют об отсутствии конфликта интересов.
About the authors
M. V. Kalyaev
Saint Petersburg State Forest Technical University; Saint Petersburg State University
Email: aleksvasil@mail.ru
Russian Federation, Institutsky per., 5, Saint Petersburg, 194021; Universitetskaya nab., 7/9, Saint Petersburg, 199034
D. S. Ryabukhin
Saint Petersburg State Forest Technical University; All-Russia Research Institute for Food Additives, V.M. Gorbatov Federal Research Center for Food Systems of RAS
Email: aleksvasil@mail.ru
ORCID iD: 0000-0001-5345-0038
Russian Federation, Institutsky per., 5, Saint Petersburg, 194021; Liteyniy pr., 55, Saint Petersburg, 191014
A. V. Vasilyev
Saint Petersburg State Forest Technical University; Saint Petersburg State University
Author for correspondence.
Email: aleksvasil@mail.ru
ORCID iD: 0000-0003-3628-1492
Russian Federation, Institutsky per., 5, Saint Petersburg, 194021; Universitetskaya nab., 7/9, Saint Petersburg, 199034
References
- Hiyama T. Organofluorine compounds. Chemistry and applications. Berlin: Springer, 2000.
- Chambers R. D. Fluorine in organic chemistry. Oxford, 2004.
- Kirsch P. Modern fluoroorganic chemistry: synthesis, reactivity, applications. Weinheim: Wiley-VCH, 2004.
- Uneyama K. Organofluorine chemistry. Oxford: Blackwell, 2006.
- Theodoridis G. Fluorine-containing agrochemicals: an overview of recent developments // Advances in Fluorine Science. Ed. A. Tressaud. Amsterdam: Elsevier. 2006, 2, 121–175.
- Begue J. P., Bonnet-Delpon D. Bioorganic and medicinal chemistry of fluorine. Hoboken: Wiley, 2008.
- Fluorine and health: molecular imaging, biomedical materials and pharmaceuticals. Eds. A. Tressaud, G. Haufe. Amsterdam: Elsevier, 2008.
- Fluorinated heterocyclic compounds: synthesis, chemistry, and applications. Ed. V.A. Petrov, Hoboken: Wiley, 2009.
- Fluorine in heterocyclic chemistry. Ed. V.G. Nenajdenko. Berlin: Springer, 2014.
- Prakash R.V. Organofluorine compounds in biology and medicine. Amsterdam: Elsevier, 2015.
- Fluorinated pharmaceuticals: advances in medicinal chemistry. Ed. A.D. Westwell. London: Future Science Ltd, 2015.
- Modern synthesis processes and reactivity of fluorinated compounds. Progress in fluorine science. Eds. H. Groult, F.R. Leroux, A. Tressaud. Amsterdam: Elsevier, 2017.
- Late-stage fluorination of bioactive molecules and biologically-relevant substrates. Ed. A. Postigo. Amsterdam: Elsevier, 2018.
- Champagne P.A., Desroches J., Hamel J.-D., Vandamme M., Paquin J.-F. Chem. Rev. 2015, 115, 9073–9174. doi: 10.1021/cr500706a
- Шаинян Б.А., Данилевич Ю.С., Григорьева А.А., Чувашев Ю.А. ЖОрХ. 2003, 39, 1651–1656. [Shainyan B.A., Danilevich Yu.S., Grigor’eva A.A., Chuvashev Yu.A. Russ. J. Org. Chem. 2003, 39, 1581–1586.] doi: 10.1023/B:RUJO.0000013131.19936.5e
- Шаинян Б.А., Данилевич Ю.С., Григорьева А.А., Чувашев Ю.А. ЖОрХ. 2004, 40, 544–548. [Shainyan B.A., Danilevich Yu.S., Grigor’eva A.A., Chuvashev Yu.A., Russ. J. Org. Chem. 2004, 40, 513–517.] doi: 10.1023/B:RUJO.0000036072.78258.c2
- Шаинян Б.А., Данилевич Ю.С. ЖОрХ. 2006, 42, 231–235. [Shainyan B.A., Danilevich Yu.S., Russ. J. Org. Chem. 2006, 42, 214–219.] doi: 10.1134/S1070428002120096
- Polczynski P., Jurczakowski R., Grzelak A., Goreshnik E., Mazej Z., Grochala W. Chem. Eur. J. 2019, 25, 4927–4930. doi: 10.1002/chem.201806274
- Polczynski P., Jurczakowski R., Mazej Z., Dobrzycki L., Grzelak A., Grochala W. Eur. J. Inorg. Chem. 2020, 33 3151–3157. doi: 10.1002/ejic.202000363
- A.E. Feiring, J. Fluor. Chem. 1977, 10, 375–386. doi: 10.1016/S0022-1139(00)82143-0
- A.E. Feiring, J. Org. Chem. 1979, 44, 1252–1254. doi: 10.1021/jo01322a013
- Щукин А.О., Васильев А.В., Фукин Г.К., Руденко А.П. ЖОрХ. 2007, 43, 1455–1459. [Shchukin A.O., Vasilyev A.V., Fukin G.K., Rudenko A.P. Russ. J. Org. Chem. 2007, 43, 1446–1450.] doi: 10.1134/S1070428007100065
- G.A. Olah, J. T. Welch, Y.D. Vankar, M. Nojima, I. Kerekes, J.A. Olah, J. Org. Chem. 1979, 44, 3872–3881. doi: 10.1021/jo01336a027
- Chen C., Chien C.-T., Su C.-H., J. Fluor. Chem. 2002, 115, 75–77. doi: 10.1016/S0022-1139(02)00004-0
- Ranjith J., Rajesh N., Sridhar B., Krishna P.R. Org. Biomol. Chem. 2016, 14, 10074–10079. doi: 10.1039/c6ob01752e
- Hiraoka T., Yano S., Hara S. Synthesis. 2016, 48, 1353–1358. doi: 10.1055/s-0035-1561374
- Marzijarani N.S., Snead D.R., McMullen J.P., Leve-son F., Weisel M., Varsolona R.J., Lam Y., Liu Z., Naber J.R. Org. Process Res. Dev. 2019, 23, 1522–1528. doi: 10.1021/acs.oprd.9b00178
- Golushko A.A., Dar’in D.V., Kantin G.P., Guranova N., Vasilyev A.V., Krasavin M.Yu. Synthesis. 2019, 51, 3815–3824. doi: 10.1055/s-0037-1611882
- Vasilyev A.V. Mini-Rev. Org. Chem. 2017, 14, 204–206. doi: 10.2174/1570193X14666170208101802
- Санджиева М.А., Арямова Е.С., Сухаржевский С.М., Гриненко Е.В., Васильев А.В. ЖОрХ. 2017, 54, 393–398. [Sandzhieva M.A., Aryamova E.S., Sukharzhevskii S.M., Grinenko E.V., Vasilyev A.V. Russ. J. Org. Chem. 2018, 54, 393–398.] doi: 10.1134/S1070428018030053
- Miyaura N. Cross-Coupling Reactionс: A Practical Guide. Berlin–Heidelberg: Springer, 2002.
- Niсhihara Y. Applied Cross-Coupling Reactions. Berlin–Heidelberg: Springer, 2013.
- De Meijere A., Diederich F. Metal-Catalyzed Cross-Coupling Reactions, 2nd ed. Weinheim: Wiley-VCH, 2004.
- Руденко А.П. ЖОрХ. 1994, 30, 1847–1881. [Ruden-ko A.P. Russ. J. Org. Chem. 1994, 30, 1802–1833.]
Supplementary files